GÉNÉRALITÉS
La résistance des bactéries aux antibiotiques peut être naturelle ou acquise. La résistance naturelle est caractéristique de l’ensemble des isolats d’une espèce ou d’un genre bactérien. Elle est transmissible à la descendance car portée par le chromosome. Elle définit le spectre antibactérien des espèces bactériennes ainsi que le spectre d’action des antibiotiques. Exemples : les Enterobacterales sont résistantes aux macrolides, aux glycopeptides, Listeria monocytogenes est résistante aux céphalosporines, Pseudomonas aeruginosa est résistante aux aminopénicillines…
La résistance acquise est observée chez une partie des isolats appartenant à des espèces habituellement sensibles. Cette résistance est variable en fonction de la pression de sélection et apparaît à la suite d’évènements génétiques qui peuvent être de 2 types : des mutations ou l’acquisition de gènes. La résistance peut s’exprimer soit de façon constitutive (constamment et toujours au même niveau), soit de façon inductible (uniquement en présence d’un inducteur).
LES MÉCANISMES GÉNÉTIQUES DE LA RÉSISTANCE
L’apparition de la résistance acquise est le résultat de modifications génétiques :
▶ les mutations : elles peuvent affecter une protéine ou une fonction de la bactérie (altération d’une porine de la membrane externe, modification de l’expression d’un gène ou de la structure d’une protéine cible de l’antibiotique…), elles sont spontanées et sélectionnées par la pression antibiotique. Les résistances par mutation se transmettent verticalement à la descendance mais pas horizontalement à d’autres bactéries. Elles représentent environ 20 % des résistances observées en clinique.
▶ les acquisitions de gènes, souvent médiées par un support génétique faisant partie d’un élément génétique mobile (plasmides, transposons…) : gènes d’enzymes modifiant les antibiotiques ou les cibles des antibiotiques, gènes de protéines protégeant les cibles des antibiotiques… Cette résistance est transmissible horizontalement d’une bactérie à une autre, ce qui lui confère un rôle important dans les épidémies. Cette transmission peut se faire par conjugaison grâce à des plasmides ou des transposons conjugatifs, par transduction par l’intermédiaire d’un bactériophage (virus infectant les bactéries) ou directement par transformation. La résistance par acquisition de gène représente environ 80 % des résistances observées en clinique.
LES MÉCANISMES BIOCHIMIQUES DE LA RÉSISTANCE
Ces mécanismes peuvent concerner aussi bien les résistances naturelles que les résistances acquises et sont représentés dans la figure IV.2.1.
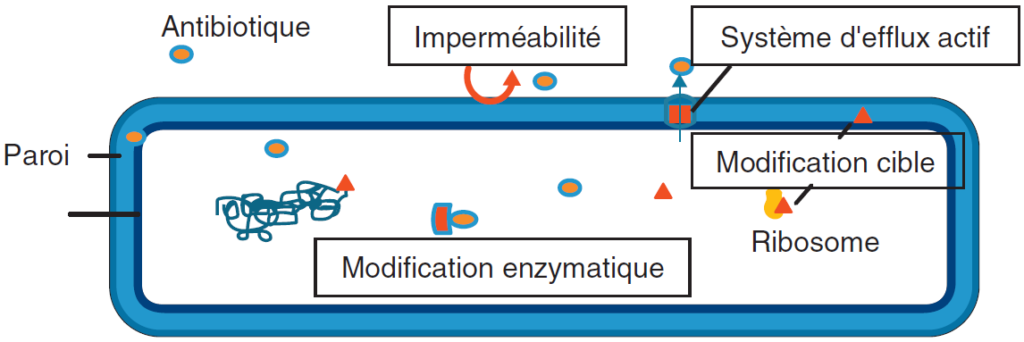
IMPERMÉABILITÉ
Ce mécanisme entraîne un défaut d’entrée de l’antibiotique dans la bactérie de façon naturelle, ou par des modifications quantitatives ou qualitatives des porines (protéines de la membrane externe des bactéries à Gram négatif), ou par la perte d’un transporteur (membrane cytoplasmique des bactéries). Elle peut toucher plusieurs familles d’antibiotiques (résistance croisée) et être associée à d’autres mécanismes de résistance comme l’efflux.
Exemples :
▶ résistance de P. aeruginosa à l’imipénème par déficit de la porine D2 par mutation ;
▶ résistance naturelle des bactéries à Gram négatif aux glycopeptides, qui sont de grosses molécules ne pouvant pas franchir la membrane externe de ces bactéries ;
▶ résistance naturelle aux aminosides des bactéries anaérobies strictes et des bactéries anaérobies préférentielles, comme les streptocoques, par imperméabilité, par défaut de transport actif (le passage de la membrane cytoplasmique nécessite l’énergie produite par les chaînes respiratoires aérobies).
EFFLUX
Les systèmes d’efflux sont des systèmes de transport transmembranaires dont le rôle est de maintenir l’équilibre physico-chimique de la bactérie en éliminant des molécules potentiellement toxiques, comme les antibiotiques. La résistance est liée soit à l’hyperproduction d’un système existant (chromosomique) par mutation, soit à l’acquisition de gènes étrangers (transposons, plasmides). Elle touche généralement plusieurs familles d’antibiotiques.
INACTIVATION DE L’ANTIBIOTIQUE
C’est le mécanisme de résistance le plus fréquent, notamment chez les bactéries à Gram négatif. La résistance est liée à la production d’enzymes inactivatrices ou modificatrices codées par des gènes chromosomiques ou plasmidiques, naturels ou acquis (tableau IV.2.1). Les enzymes agissent soit par destruction de l’antibiotique, soit par ajout de radicaux empêchant/ diminuant la fixation de l’antibiotique à sa cible.
Tableau IV.2.1 Bactéries pouvant produire des bêta-lactamases.

PRODUCTION D’ENZYMES INACTIVATRICES DE L’ANTIBIOTIQUE
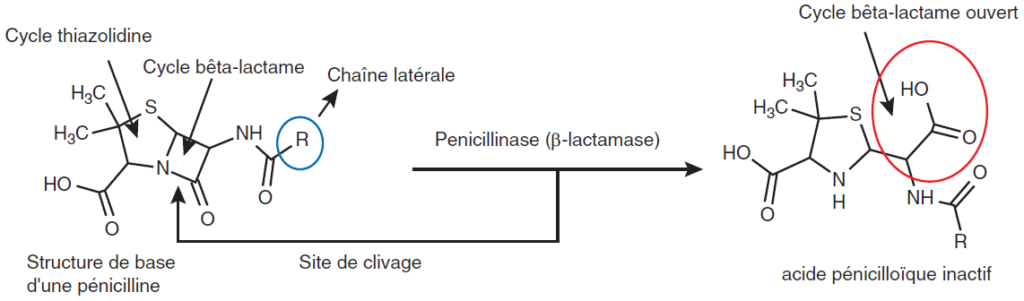
La production de bêta-lactamases, enzymes hydrolysant le cycle bêtalactame et conduisant à l’inactivation d’un nombre plus ou moins important de bêta-lactamines, est un mécanisme essentiel de la résistance aux bêta-lactamines (figure IV.2.2). Parmi les bêta-lactamases, certaines ont plus d’affinité pour les pénicillines, on parle alors de pénicillinases, d’autres ont plus d’affinité pour les céphalosporines, on parle de céphalosporinases. Certaines ont un spectre étendu qui va toucher plus de molécules comme les bêta-lactamases à spectre étendu, ou BLSE, qui touchent les céphalosporines de 3e génération. Les carbapénémases hydrolysent les carbapénèmes.
PRODUCTION D’ENZYMES MODIFIANT L’ANTIBIOTIQUE
C’est le mécanisme principal de résistance des bactéries aux aminosides. Trois classes d’enzymes sont impliquées : les aminosides acétyltransférases, phosphotransférases, et nucléotidyltransférases. Elles permettent la fixation de résidus sur les aminosides, diminuant ainsi leur affinité pour leur cible. Les gènes codant pour ces enzymes sont souvent acquis via différents éléments génétiques mobiles (plasmides +++).
PERTE DE L’AFFINITÉ DE L’ANTIBIOTIQUE POUR SA CIBLE
Ce mécanisme confère généralement des résistances de haut niveau et s’observe fréquemment chez les cocci à Gram positif. Il peut correspondre à une absence de cible, à une modification de la cible par mutations chromosomiques ou par l’action d’enzymes modificatrices, ou à l’acquisition de cibles exogènes additionnelles de faible affinité.
Exemples :
▶ Résistance à la méticilline chez les staphylocoques (SARM : Staphylococcus aureus résistant à la méticilline). Elle est due à l’acquisition d’une nouvelle cible des bêta-lactamines (PLP : protéines liant les pénicillines), la PLP2a, ayant très peu d’affinité pour les bêta-lactamines. Cette résistance est croisée à toutes les bêta-lactamines. La PLP2a est codée par le gène mecA présent sur un élément mobile intégré dans le chromosome.
▶ Diminution de la sensibilité aux bêta-lactamines chez le pneumocoque : contrairement à Streptococcus agalactiae qui reste sensible à l’amoxicilline, le pneumocoque peut acquérir des résistances aux bêta-lactamines par modifications de ses PLP, secondairement à des recombinaisons homologues entre ses gènes de PLP et ceux de streptocoques non groupables de la flore oropharyngée, après transformation (le pneumocoque est naturellement transformable). Ce phénomène à l’origine de gènes mosaïques explique l’existence de pneumocoques de sensibilité diminuée à la pénicilline : PSDP).
▶ Résistance aux macrolides et apparentés (MLS) par acquisition d’une méthylase plasmidique (gène erm) qui méthyle la cible de ces antibiotiques, l’ARN ribosomal 23S diminuant ainsi son affinité pour les MLS.
▶ Résistance aux quinolones par mutations chromosomiques de leur cible, les gènes codant l’ADN gyrase ou la topo-isomérase IV.
▶ Résistance aux tétracyclines par protection de la cible grâce à des protéines Tet, analogues de facteurs d’élongation, déplaçant et gênant la fixation des tétracyclines sur l’ARN ribosomal 16S.
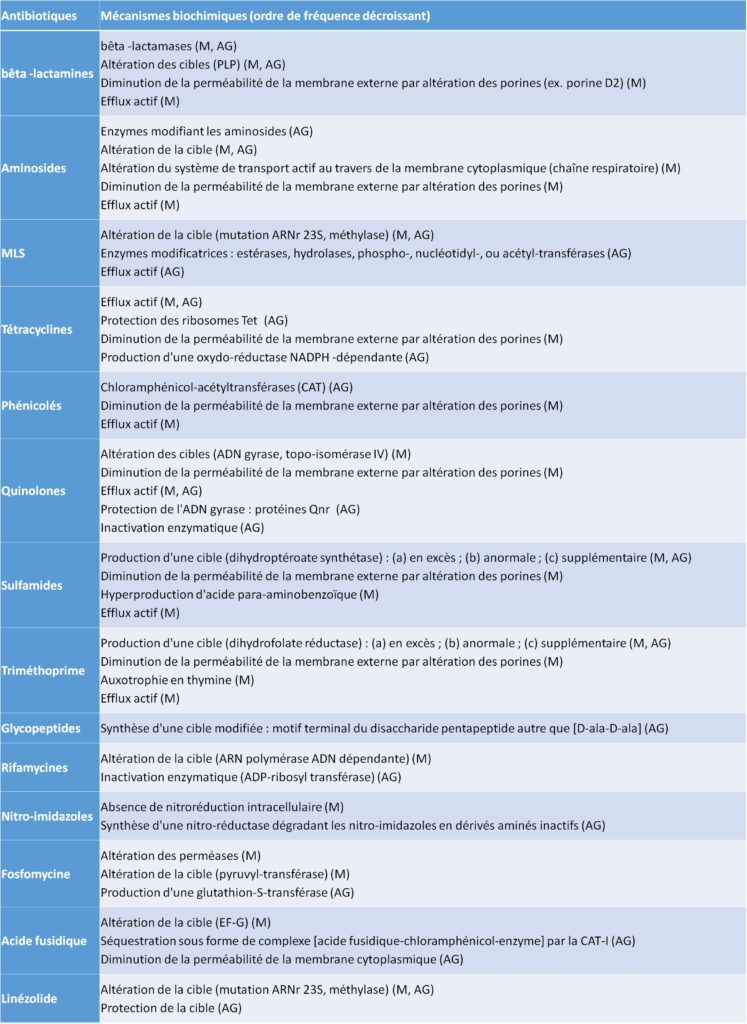
LES MÉCANISMES DE RÉSISTANCE PAR GRANDES FAMILLES D’ANTIBIOTIQUES
Les différents mécanismes de résistance retrouvés pour chaque famille d’antibiotique sont regroupés dans le tableau IV.2.2 suivant.
Tableau IV.2.2 Mécanismes de résistance vis-à-vis des différentes familles d’antibiotiques
(M : mutation, AG : acquisition de gène).