M. tuberculosis également appelé bacille de Koch (BK) est l’agent principal de la tuberculose (environ 98 % des cas en France). À l’opposé existent les mycobactéries non tuberculeuses, présentes dans l’environnement, également appelées mycobactéries atypiques qui sont des pathogènes opportunistes et dont les pathologies sont appelées mycobactérioses.
CARACTÉRISTIQUES BACTÉRIOLOGIQUES
TAXONOMIE
M. tuberculosis appartient au genre Mycobacterium. Génétiquement très proches, les espèces M. africanum, M. bovis, et M. bovis BCG (la souche de virulence atténuée utilisée en vaccination) sont, avec M. tuberculosis, regroupées sous la dénomination mycobactéries du groupe de la tuberculose ou du complexe tuberculosis. En dehors de M. bovis BCG, elles sont responsables de la tuberculose.
MORPHOLOGIE, CARACTÈRES CULTURAUX ET D’IDENTIFICATION
M. tuberculosis est un bacille, aérobie stricte, présentant des exigences culturales particulières. Cette bactérie est non sporulée.
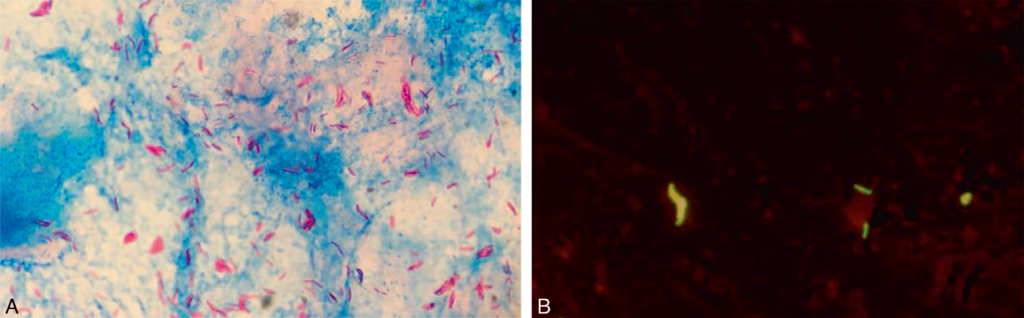
M. tuberculosis est un bacille-acido-alcoolo-résistant (BAAR) qui n’est pas colorable par la coloration de Gram. Il est visualisable à l’aide de colorations spéciales comme la coloration de référence Ziehl-Neelsen (les mycobactéries apparaissent roses sur fond bleu) et la coloration à l’auramine (les mycobactéries apparaissent jaune-vert fluorescentes sur un fond orangé (figure II.9.1).
Les différentes propriétés particulières des mycobactéries tuberculeuses sont liées à l’existence d’une paroi originale composée de sucres particuliers (arabinogalactane), d’acides gras à longue chaîne (acides mycoliques), de lipo-arabinomannane (LAM) et de cires. La paroi très riche en lipides explique les propriétés suivantes :
▶ la croissance est lente : le temps de division de M. tuberculosis est de 20–24 h ;
▶ croissance sur milieux spécifiques :
▪ culture sur milieu solide type Löwenstein-Jensen (LJ) ou Coletsos (base = sels biliaires-oeuf coagulé ou acides gras à longue chaîne). Le délai minimum est de 3 semaines pour obtenir des colonies visibles ;
▪ culture en milieu liquide (base Middlebrook) avec détection en 5–15 jours en fonction de la charge bactérienne.
▶ Propriété tinctoriale particulière nécessitant des colorations spécifiques (Ziehl-Neelsen ou auramine).
▶ Résistance aux acides, aux bases, aux détergents.
▶ Résistance à la plupart des antibiotiques « classiques ».
▶ Traitement prolongé (au moins 6 mois).
| Points clés La richesse en lipides de la paroi des mycobactéries explique les propriétés particulières de cette bactérie (croissance lente, culture sur milieux particuliers, colorations spéciales, résistance aux acides, bases et détergents, résistance à de nombreux antibiotiques « classiques », etc.). |
DONNÉES ÉPIDÉMIOLOGIQUES
Un tiers de la population mondiale est infecté par le bacille tuberculeux.
Environ 10 millions de nouveaux cas de tuberculose maladie (voir paragraphe physiopathologie) sont recensés chaque année dans le monde dont 1 million d’enfants. 95 % de ces cas surviennent dans des pays à ressources limitées (incidence élevée en Afrique). En France, l’incidence est inférieure à 8 nouveaux cas pour 100 000 habitants par an, ce qui repré sente environ 5 000 nouveaux cas de tuberculose par an. Les hommes sont plus souvent touchés que les femmes.
Il y a 1,2 à 1,5 million de morts par an dans le monde de tuberculose.
Dans le monde, environ 500 000 cas sont des cas de tuberculose multirésistante. La multirésistance ou multi drug resistance (MDR) est définie par une infection avec une souche résistante à la fois à l’isoniazide et à la rifampicine.
| Points clés On recense 10 millions de nouveaux cas par an de tuberculose maladie (c’est-à-dire associée à des signes cliniques de la maladie) dont plus d’un million de morts par an dans le monde. Les pays à ressources limitées sont les plus touchés. |
PHYSIOPATHOLOGIE ET MANIFESTATIONS CLINIQUES
M. tuberculosis est un pathogène strictement humain. M. bovis a un spectre d’hôte beaucoup plus large. PHYSIOPATHOLOGIE La transmission de la tuberculose s’effectue par voie aérienne respiratoire en inhalant des particules en suspension contenant quelques bacilles tuberculeux (gouttelettes de Flügge). Ces bacilles sont émis par un sujet atteint de tuberculose pulmonaire (sujet bacillifère), en particulier lorsqu’il parle, tousse ou crache.
La dose infectante est faible, environ 10 bacilles.
La promiscuité et la durée d’exposition ainsi que l’inoculum, les manoeuvres expiratoires forcées (toux, kinésithérapie, éternuement, expectorations induites) ou une excavation pulmonaire constituent des circonstances de majoration de la transmission.
Les bacilles inhalés vont atteindre les alvéoles pulmonaires et seront phagocytés par les macrophages alvéolaires. Le système immunitaire va mettre en place une immunité cellulaire (hypersensibilité retardée de type IV) en 4 à 6 semaines qui conférera au macrophage alvéolaire de nouvelles propriétés le rendant apte à se débarrasser des bacilles tuberculeux.
Les macrophages, les lymphocytes T et B ainsi que les fibroblastes vont s’organiser pour former un granulome. Certains macrophages vont fusionner pour former des cellules géantes (cellules épithélioïdes géantes plurinucléées de Langhans).
Dans 90–95 % des cas, le système immunitaire bloquera l’infection sans expression de signes cliniques. Le granulome « bloque » le développement de l’infection. On parle dans cette situation d’infection tuberculeuse latente (ITL). On parle de tuberculose maladie lorsqu’il y a expression clinique de la maladie (voir « Manifestations cliniques de la tuberculose maladie »).
Compte tenu des enjeux de santé publique, le diagnostic de tuberculose maladie ainsi que le diagnostic d’ITL chez l’enfant de moins de 15 ans sont à déclaration obligatoire.
MANIFESTATIONS CLINIQUES DE LA TUBERCULOSE MALADIE
Les signes cliniques d’ITL sont au maximum un syndrome pseudo-grippal et passent en général inaperçus.
Les manifestations cliniques de la tuberculose maladie sont pulmonaires dans 70 % des cas (formes pulmonaires seules ou associées à une forme extrapulmonaire). Dans 30 % des cas, des formes extrapulmonaires sont retrouvées isolément.
ATTEINTE PULMONAIRE
La tuberculose est avant tout une maladie pulmonaire d’installation progressive pendant plusieurs semaines (toux, crachats pouvant être mêlés de sang (hémoptysies), dyspnée, altération de l’état général : fatigue, amaigrissement, fièvre modérée, sueurs nocturnes).
ATTEINTES EXTRAPULMONAIRES
Les atteintes extrapulmonaires sont principalement ganglionnaires puis osseuses (spondylodiscite, Mal de Pott), méningées, génitales, rénales…
Chez l’enfant et l’immunodéprimé, une forme particulière correspondant à la diffusion systémique des bacilles avec constitution d’une multitude de granulomes est appelée miliaire.
FACTEURS DE RISQUE DE TUBERCULOSE
Les enfants présentent une susceptibilité beaucoup plus élevée à l’infection tuberculeuse que les adultes. Il en est de même pour les patients immunodéprimés, en particulier les patients HIV+.
Les facteurs de risque sont, en France, le pays de naissance (en particulier en Afrique subsaharienne), les conditions de vie. L’infection tuberculeuse touche majoritairement les SDF, les migrants, les prisonniers et les personnes âgées.
| Points clés Différence entre l’infection tuberculeuse latente et tuberculose maladie. Rôle essentiel de l’immunité cellulaire. Maladie pulmonaire chronique. Parmi les formes extrapulmonaires, les formes ganglionnaires sont les plus fréquentes. Maladie contagieuse. Plus grande sensibilité des enfants et des patients HIV+. |
DIAGNOSTIC
Le diagnostic de tuberculose maladie à partir de la suspicion clinique et radiologique, éventuellement couplé à des données anatomo-pathologiques devra être confirmé par la recherche bactériologique des bacilles tuberculeux.
Le diagnostic d’ITL repose, quant à lui, uniquement sur des tests immunologiques comme l’intradermoréaction à la tuberculine (IDR) et au dosage in vitro d’interféron gamma produit (Interferon Gamma Release Assay — IGRA) après stimulation des lymphocytes du patient par des antigènes spécifiques.
DIAGNOSTIC DIRECT
M. tuberculosis est recherché dans les prélèvements respiratoires, en particulier les crachats ou expectorations, et dans l’analyse des sécrétions respiratoires de la nuit recueillies par tubage gastrique le matin (patient à jeun). Les prélèvements sont répétés le plus souvent 3 jours de suite.
Autres prélèvements : aspirations bronchiques, liquides de lavage bronchoalvéolaire.
Dans les formes extrapulmonaires, les prélèvements dépendent des sites potentiellement infectés (ponction de LCR dans les méningites, ponctions/biopsie ganglionnaires ou vertébrales, urines…).
Les prélèvements doivent être manipulés dans un laboratoire de sécurité de niveau 3.
Les échantillons potentiellement contaminés par un microbiote commensal, en particulier oropharyngé, subissent un traitement (fluidification par de la N-acétylcystéine et décontamination par de la soude diluée).
EXAMEN MICROSCOPIQUE
Les échantillons traités ou non sont colorés afin de visualiser les mycobactéries. L’examen microscopique après coloration permet de mettre en évidence des BAAR. Coloration de référence de Ziehl-Neelsen (mycobactéries apparaissent roses sur un fond bleu, voir figure II.9.1A), ou coloration à l’auramine (colorant fluorescent).
La positivité de l’examen microscopique nécessite au moins 104 bacilles/mL. Un résultat semi-quantitatif est donné au clinicien, permettant d’apprécier la quantité de bacilles dans l’échantillon.
Un résultat négatif n’exclura pas le diagnostic de tuberculose maladie.
CULTURE ET IDENTIFICATION
L’échantillon est mis en culture à la fois sur un milieu solide (Löwenstein-Jensen ou Coletsos) et sur un milieu liquide (Middlebrook). Des automates peuvent être utilisés, permettant une détection plus rapide de la culture en milieu liquide. Le délai d’obtention des colonies sur milieu solide est d’environ 3 semaines et de 5 à 15 jours en milieu liquide (figure II.9.2). Les cultures sont rendues négatives après 3 mois d’incubation.
En cas de culture positive, après vérification qu’il s’agit bien d’un BAAR, un test immunochromatographique est effectué afin de rechercher un antigène présent uniquement chez les souches de M. tuberculosis, M. africanum et M. bovis (Ag MPT64) (figure II.9.2). L’identification précise de l’espèce se fera dans un second temps par biologie moléculaire. En cas de positivité de l’Ag MPT64, un antibiogramme et une identification précise de l’espèce seront effectués.
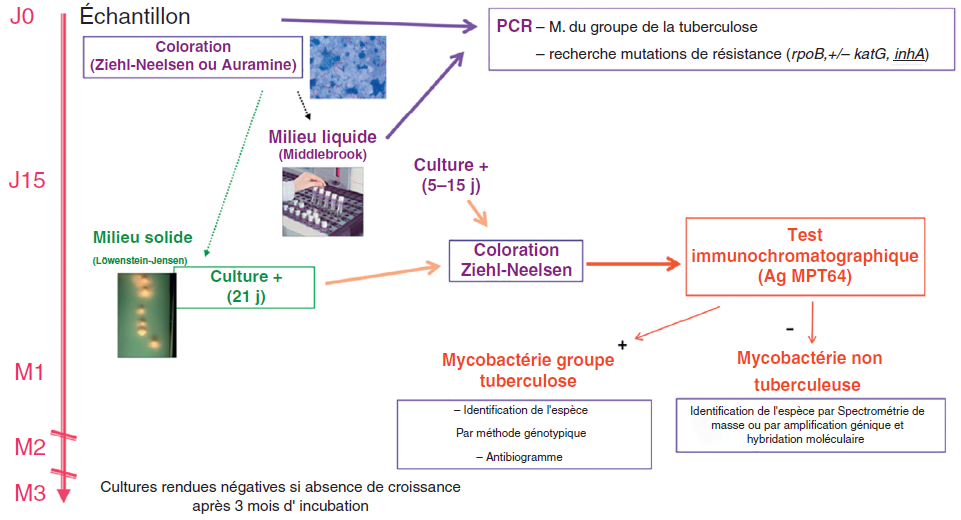
AUTRES MÉTHODES DE DÉTECTION
La PCR peut être effectuée directement sur l’échantillon et permet de détecter les mycobactéries du groupe de la tuberculose. Une recherche simultanée de mutations sur le gène rpoB qui, si elles sont présentes, confèrent une résistance à la rifampicine est recommandée. Conjointement, il est possible de rechercher des mutations conférant la résistance à l’isoniazide (gène katG et inhA).
DIAGNOSTIC INDIRECT
Il n’existe pas de diagnostic sérologique.
DIAGNOSTIC D’INFECTION TUBERCULEUSE LATENTE
Le diagnostic d’ITL repose uniquement sur des tests immunologiques :
▶ l’IDR à la tuberculine ;
▶ la lecture du diamètre d’induration 3 jours après injection dans le derme de tuberculine purifiée. Test positif si > à 5 mm ;
▶ le dosage de l’interféron gamma libéré par les lymphocytes après contact avec des antigènes de mycobactéries tuberculeuses (interferon gamma release assay – test IGRA). La positivité de l’IDR ou du test IGRA signe un contact avec un bacille tuberculeux, sans préjuger du caractère infection ou maladie.
SENSIBILITÉ AUX ANTIBIOTIQUES ET ANTIBIOGRAMME
Les souches de M. tuberculosis isolées en France sont habituellement sensibles aux antituberculeux de première ligne isoniazide (INH) ; rifampicine (RIF), éthambutol (EMB) et pyrazinamide (PZA) (> 95 % des cas). Les souches MDR (résistantes à INH et RIF) représentent environ 2 % des souches.
La recherche de résistance aux antituberculeux est indispensable. L’antibiogramme est effectué par la « méthode des proportions ». Il permet de mettre en évidence une résistance primaire (chez un patient sans antécédent de tuberculose) ou plus fréquemment une résistance secondaire acquise sous traitement ou lors d’un traitement précédent.
| Points clés L’antibiogramme est obligatoire. Il est basé sur la méthode des proportions. Les résistances aux antituberculeux sont dues à des mutations spontanées. |
TRAITEMENT
Le schéma thérapeutique habituel dans la prise en charge d’une tuberculose pulmonaire à bacilles sensibles est présenté. Il consiste à la prise de INH + RIF + PZA + EMB pendant les 2 premiers mois puis de INH + RIF les 4 mois suivants.
L’association des 4 antituberculeux permet d’éviter la sélection de mutants. L’activité des molécules diffère selon le compartiment infecté. Enfin, cette association permet de diminuer la durée du traitement qui est habituellement de 6 mois pour une tuberculose pulmonaire.
Le traitement consiste en une prise unique le matin à jeun pour une meilleure absorption de la rifampicine. Le traitement d’une ITL repose sur l’utilisation de INH + RIF pendant 3 mois ou de INH seul pour 6 à 9 mois.
Les principaux effets secondaires sont hépatiques, rénaux et ophtalmologiques.
L’atteinte hépatique peut être est due à INH, RIF et/ou PZA. La rifampicine est peu hépatotoxique seule. L’isoniazide est souvent hépatotoxique (hépatotoxicité de ses métabolites, surtout en association avec la rifampicine). Le pyrazinamide est souvent hépatotoxique. Si les transaminases sont > à 6 fois la normale, il faut envisager des modifications thérapeutiques.
L’atteinte rénale peut être due à INH et RIF.
L’atteinte ophtalmique est due à l’EMB.
Une hyperuricémie est possible en lien avec le PZA. Le PZA et ses métabolites sont excrétés en compétition avec l’acide urique au niveau rénal.
PRÉVENTION
PRÉVENTION DE LA TRANSMISSION
Dès la suspicion de tuberculose, le patient est hospitalisé et placé en isolement respiratoire (précautions complémentaires « AIR »).
La levée de l’isolement est liée à la négativité des examens microscopiques et au moins 15 jours après le début du traitement si la bactérie est sensible aux antituberculeux et si le patient s’améliore cliniquement.
Déclaration obligatoire (DO) anonyme auprès de l’agence régionale de santé et signalement auprès du CLAT (Centre de lutte antituberculeuse) du département du domicile du patient.
VACCINATION
La vaccination par le BCG (M. bovis BCG, bacille bilié de Calmette et Guérin de virulence atténuée) n’est plus obligatoire depuis 2007 en France. Le BCG protège les enfants des formes graves de tuberculose.
La vaccination reste recommandée pour les enfants en cas de séjours fréquents ou supérieurs à un mois dans les pays à forte incidence tuberculeuse. Elle peut être réalisée jusqu’à l’âge de 15 ans.
La vaccination par le BCG est strictement contre-indiquée dans les déficits immunitaires congénitaux ou acquis touchant l’immunité cellulaire, et chez les patients infectés par le HIV, quel que soit le taux de CD4.
