La nomenclature a récemment reclassé Clostridium difficile qui s’appelle dorénavant Clostridioides difficile.
CARACTÉRISTIQUES BACTÉRIOLOGIQUES
TAXONOMIE
Embranchement des Firmicutes, classe des Clostridia, ordre des Eubacteriales, famille des Peptostreptococcaceae, genre Clostridioides.
MORPHOLOGIE, CARACTÈRES CULTURAUX ET D’IDENTIFICATION
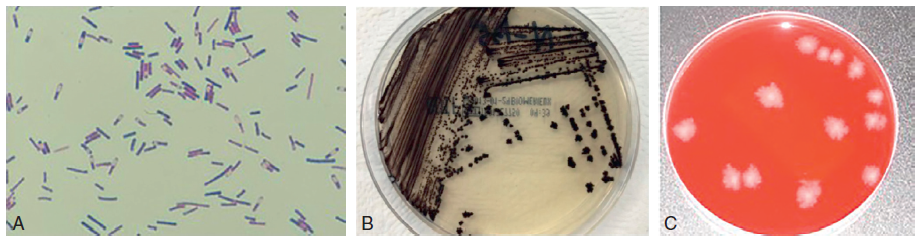
Bacille à Gram positif, sporulé (figure II.3.1A). C. difficile est une bactérie anaérobie stricte. Les colonies de C. difficile obtenues après 24 à 48 heures d’incubation à 37 °C ont un diamètre de 3 à 5 mm, sont circulaires à bords irréguliers, non hémolytiques (figure II.3.1B). Leur odeur est caractéristique (crottin de cheval).
FACTEURS DE VIRULENCE
Seules les souches toxinogènes sont pathogènes. Elles produisent 2 toxines protéiques : la toxine A (TcdA) et la toxine B (ou TcdB). D’autres facteurs pourraient intervenir dans la virulence des souches comme la toxine binaire.
| Points clés ● Seules les souches toxinogènes de C. difficile, produisant les toxines A et B, sont pathogènes. |
DONNÉES ÉPIDÉMIOLOGIQUES
L’augmentation régulière de l’incidence des infections à C. difficile (ICD) ces 15 dernières années est liée d’une part à l’amélioration du diagnostic de ces infections et d’autre part, à l’émergence, à partir de 2004, d’un clone plus virulent (PCR [Polymerase Chain Reaction] ribotype 027), responsable de nombreuses épidémies à travers le monde.
Actuellement, environ 20 000 patients hospitalisés développent chaque année en France une ICD. Les ICD sont également devenues plus fréquentes en milieu communautaire.
PHYSIOPATHOLOGIE ET MANIFESTATIONS CLINIQUES
HABITAT
C. difficile est un germe commensal que l’on retrouve dans le tube digestif des Hommes et des animaux ainsi que dans l’environnement et parfois dans les aliments.
PHYSIOPATHOLOGIE
À l’état physiologique, les bactéries du microbiote intestinal exercent une fonction barrière en protégeant l’hôte des micro-organismes pathogènes. Les antibiotiques entraînent une dysbiose intestinale et favorisent l’émergence de bactéries pathogènes comme C. difficile, d’origine endogène (déjà présent dans le microbiote intestinal) ou exogène (acquis lors d’une hospitalisation).
Une fois implantées, les souches de C. difficile sécrètent les toxines A et B, à l’origine d’une altération du cytosquelette des cellules épithéliales et d’une distension des jonctions serrées intercellulaires. Elles induisent également une réaction inflammatoire intense avec recrutement de polynucléaires neutrophiles et de monocytes au niveau de la lamina propria.
PRINCIPALES MANIFESTATIONS CLINIQUES
C. difficile est responsable de :
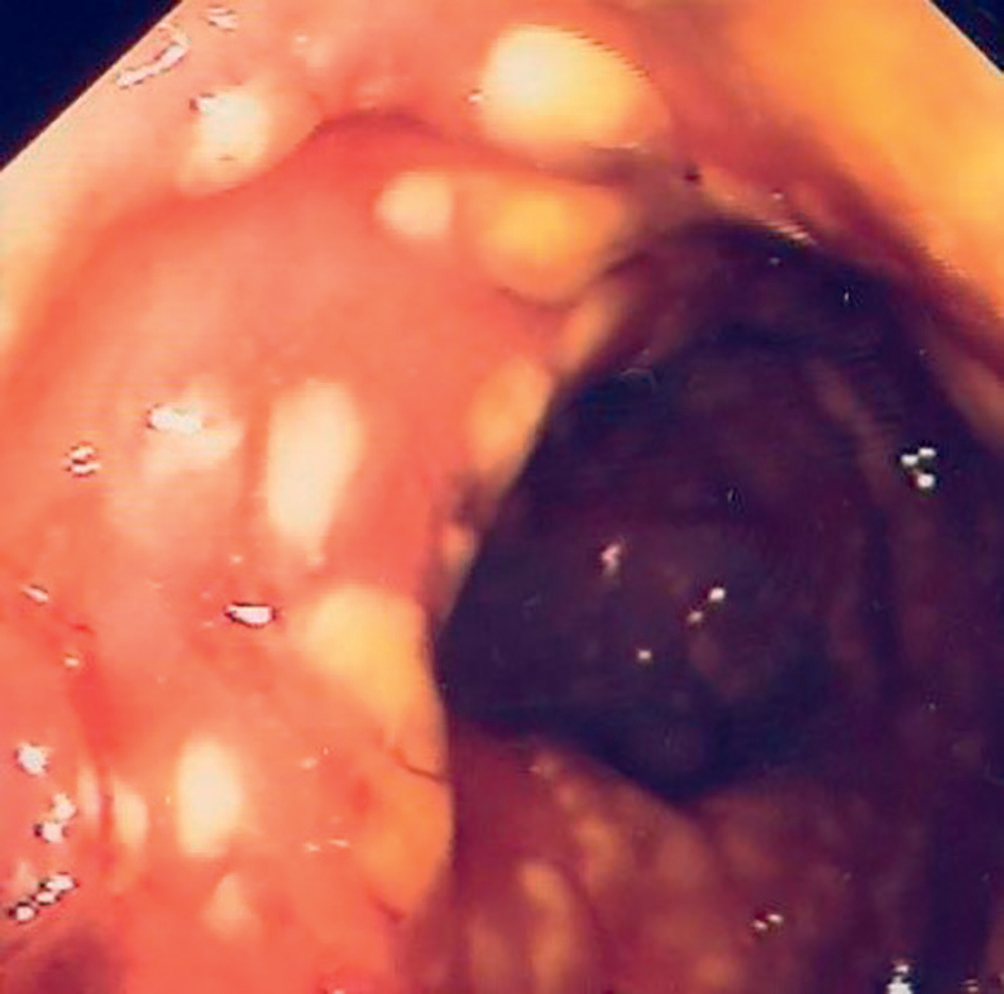
▶ > 95 % des colites pseudomembraneuses (CPM) caractérisées par la présence de pseudomembranes lors de l’examen endoscopique (figure II.3.2). Les principales complications de la CPM sont la colite fulminante, le mégacôlon toxique et le choc septique ;
▶ 15–25 % des diarrhées post-antibiotiques. Les récidives sont observées chez environ 25 % des patients après un premier épisode ;
▶ 1 à 3 % des diarrhées d’origine communautaire. C. difficile est le principal agent responsable de diarrhées nosocomiales chez l’adulte.
La mortalité directement imputable à une diarrhée simple liée à C. difficile est habituellement inférieure à 1 % mais elle peut atteindre 30 à 50 % dans les formes compliquées. Le portage asymptomatique de C. difficile est rare chez les patients adultes (3 %) mais très fréquent chez les enfants de moins de 2 ans (70 %).
FACTEURS DE RISQUE
Les principaux facteurs de risque d’ICD sont :
▶ l’administration d’antibiotiques qui modifient le microbiote intestinal. Les antibiotiques les plus à risque sont : clindamycine, céphalosporines, association amoxicilline/acide clavulanique, nouvelles fluoroquinolones ;
▶ l’âge supérieur à 65 ans ;
▶ les patients présentant des comorbidités (cancer, hémopathies malignes, insuffisance rénale…) ;
▶ les hospitalisations répétées ou prolongées.
| Points clés ● C. difficile est le principal agent responsable de diarrhées post-antibiotiques et de diarrhées nosocomiales. ● Les principaux facteurs de risque d’infections à C. difficile sont l’administration d’antibiotiques, l’âge supérieur à 65 ans et les antécédents d’hospitalisations. |
DIAGNOSTIC
DIAGNOSTIC ENDOSCOPIQUE
La visualisation de pseudomembranes au cours de l’examen endoscopique permet de poser le diagnostic d’ICD.
DIAGNOSTIC BIOLOGIQUE DIRECT
EXAMEN DIRECT
L’examen microscopique d’un frottis de selles après coloration de Gram n’est pas contributif.
CULTURE ET IDENTIFICATION
L’isolement de C. difficile s’effectue sur des milieux sélectifs contenant des antibiotiques (céfoxitine, cyclosérine) ou sur des milieux chromogéniques.
L’identification définitive des colonies caractéristiques (figure II.3.1B et 1C) peut être réalisée par spectrométrie de masse ou par l’analyse des caractères biochimiques à l’aide des galeries pour anaérobies.
AUTRES MÉTHODES DE DÉTECTION
De nombreuses méthodes existent pour le diagnostic d’ICD. On les classe en fonction de la cible détectée (figure II.3.3).

* Il s’agit de la spécificité clinique (vis-à-vis de l’infection) et non de la spécificité intrinsèque du test.
EIA : Enzymatic Immuno Assay ; ICD : infection à C. difficile ; VPN : valeur prédictive négative.
MISE EN ÉVIDENCE DE LA GLUTAMATE DÉSHYDROGÉNASE (GDH)
Enzyme pouvant être mise en évidence par des tests immuno-enzymatiques de type ELISA (Enzyme Linked Immuno-Sorbent Assay) ou par des tests immunochromatographiques unitaires rapides. Ils sont sensibles mais peu spécifiques car ils détectent aussi les souches non toxinogènes.
MISE EN ÉVIDENCE DES TOXINES DIRECTEMENT DANS LES SELLES
Test de cytotoxicité des selles
▶ Mise en évidence, après inoculation d’un filtrat de selles en culture cellulaire, d’un effet cytopathique (ECP) caractéristique ; méthode sensible et spécifique mais de réalisation longue (24 à 48 heures) et fastidieuse.
Tests immuno-enzymatiques
▶ Détection des toxines A et B dans les selles par des tests ELISA ou des tests immunochromatographiques ; spécificité excellente (> 95 %) mais sensibilité variable (de 50 % à 90 %) par rapport au test de cytotoxicité.
MISE EN ÉVIDENCE D’UNE SOUCHE TOXINOGÈNE
Culture toxigénique
▶ Consiste à isoler C. difficile puis à déterminer in vitro le caractère toxinogène de la souche isolée.
Techniques de biologie moléculaire
▶ Détection des gènes des toxines A (tcdA) ou B (tcdB) de C. difficile par PCR en temps réel ou amplification isotherme en boucle. La détection de C. difficile peut être associée à celle d’autres entéropathogènes dans le cas de diagnostic syndromique.
STRATÉGIE DIAGNOSTIQUE
Aucune des méthodes actuelles n’est suffisamment sensible et spécifique pour être utilisée seule. Les recommandations européennes et américaines préconisent l’utilisation d’un algorithme en deux étapes, basé sur l’utilisation d’une méthode très sensible de dépistage (détection de la GDH ou PCR ciblant les gènes codant les toxines) suivie, en cas de résultat positif, d’une méthode de confirmation plus spécifique mettant en évidence les toxines dans les selles. Les tests combinant la recherche de GDH et de toxines permettent un diagnostic plus rapide.
DIAGNOSTIC INDIRECT
Non utilisé.
| Points clés ● Pas de méthode unique permettant un diagnostic sensible et spécifique ; l’algorithme proposé combine une méthode sensible de dépistage et une méthode spécifique de confirmation. |
SENSIBILITÉ AUX ANTIBIOTIQUES ET ANTIBIOGRAMME
La réalisation de l’antibiogramme de C. difficile n’a pas d’intérêt pour guider le traitement des ICD car les souches sont habituellement sensibles au métronidazole, à la vancomycine et à la fidaxomicine.
TRAITEMENT
Le traitement des ICD comprend l’arrêt de tout agent ralentisseur du transit, la rééquilibration hydroélectrolytique quand elle est nécessaire et, si possible, l’interruption du ou des antibiotiques inducteurs ou leur modification pour un antibiotique à moindre risque. Le traitement médical repose sur l’administration per os de vancomycine ou de fidaxomicine. Le métronidazole n’est plus recommandé en 1re intention. Le choix du traitement est guidé par la clinique (figure II.3.4).
La transplantation de microbiote fécal est, en France, considérée comme un médicament dont la seule indication est le traitement des récidives multiples d’ICD.
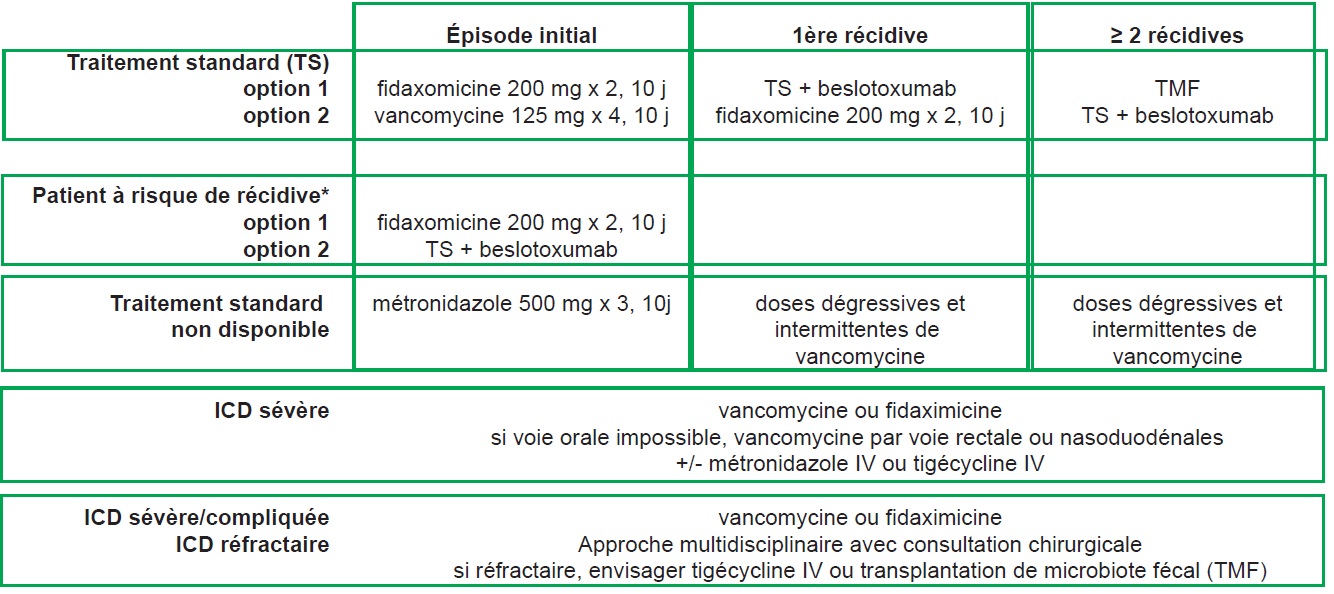
* Patient à risque de récidive : patients > 65-70 ans, antécédent d’hospitalisation ≤ 3 mois, antibiothérapie concomitante, traitement par inhibiteur de pompe à proton…
ICD : infection à C. difficile ; TMF : transplantation de microbiote fécal.
PRÉVENTION
La prévention primaire repose sur une politique de bon usage des antibiotiques.
Plusieurs candidats vaccins sont également en cours d’étude. Un anticorps monoclonal antitoxine B est commercialisé (bezlotoxumab) pour la prévention des récidives, en association d’un traitement standard chez les patients à risque de récidives. La prévention de la transmission croisée repose sur la prescription des précautions complémentaires « contact » :
▶ le placement du patient en chambre seule avec des toilettes privatives ;
▶ le renforcement de l’hygiène des mains ;
▶ le nettoyage et la désinfection quotidienne des locaux par l’eau de Javel à 0,5 % de chlore actif ou par un produit ayant une activité sporicide démontrée.
| Points clés ● Le choix du traitement dépend de la clinique. ● La prévention primaire est étroitement liée au bon usage des antibiotiques. ● La prévention de la transmission croisée repose sur les précautions complémentaires contact. |
