L’infection par le virus de l’immunodéficience humaine (HIV ou VIH) est sexuellement transmissible (IST) et responsable du syndrome d’immunodéficience acquise (SIDA). Ce tableau clinique a été décrit pour la première fois en 1981 et le HIV-1 a été isolé en 1983.
CARACTÉRISTIQUES VIROLOGIQUES
CLASSIFICATION
Famille des Retroviridae, genre Lentivirus dont 2 espèces ont émergé chez l’Homme : HIV-1 et HIV-2. Il existe une grande diversité génétique du HIV-1, divisé en 4 groupes : M responsable de la pandémie, N, O et P rares, essentiellement au Cameroun. Le groupe M est séparé en sous-types purs : de A à L, avec de très nombreuses formes circulantes recombinantes (Circulating Recombinant Forms [CRFs] et Unique Recombinant Forms [URFs]).
STRUCTURE
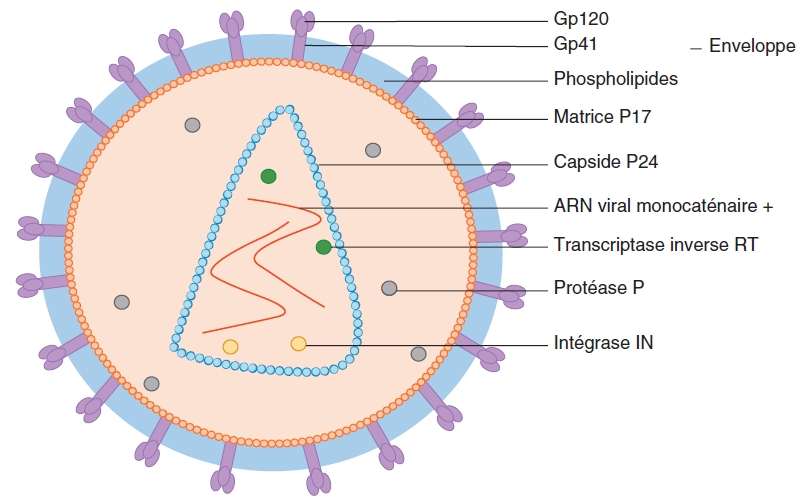
Le HIV est un virus enveloppé de 80-100 nm de diamètre (figure III.10.1). Il possède une capside conique renfermant 2 copies identiques d’ARN (acide ribonucléique) génomique monocaténaire de polarité positive de 9,2 kb chacune.
Le génome du HIV-1 contient :
▶ les gènes gag et env codant les protéines virales structurales internes à la particule virale (gag : P24 – capside, P17 – matrice) et externes (env : Gp160 clivée en Gp120 et Gp41 – glycoprotéines d’enveloppe transmembranaires) (figure III.10.1) ;
▶ le gène pol codant l’ADN (acide désoxyribonucléique) polymérase à activité transcriptase inverse (RT ou TI), l’intégrase (IN) et la protéase (P) ;
▶ 6 gènes (vif, vpr, vpu, nef, tat et rev) codant des protéines régulatrices ;
▶ des séquences Long Terminal Repeats (LTR) non codantes permettant la circularisation et l’intégration de l’ADN HIV et régulant la transcription de l’ADN proviral en ARN.
RÉPLICATION
Le HIV-1 a un tropisme pour les cellules CD4 + : lymphocytes T CD4 + essentiellement, monocytes-macrophages et cellules dendritiques.
Son entrée dans la cellule nécessite une interaction entre la Gp120 virale et sur la cellule cible avec le récepteur CD4 ainsi qu’un corécepteur, CCR5 (majoritaire en début d’infection) ou CXCR4. L’entrée du virus nécessite ensuite une fusion de l’enveloppe virale et de la membrane cytoplasmique médiée par la Gp41. La nucléocapside est alors libérée dans le cytoplasme.
Dans la nucléocapside, l’ARN viral est rétrotranscrit en ADN double brin par la transcriptase inverse virale (TI) puis transporté dans le noyau cellulaire sous forme de complexe de pré-intégration par l’intégrase virale. L’intégrase (IN) virale permet l’intégration du génome viral sous forme d’ADN proviral dans le génome de l’hôte, forme de latence du HIV. Les ARNm viraux sont ensuite transcrits puis traduits en protéines par la machinerie cellulaire dans le cytoplasme (Gag et Gag-Pol) ou le réticulum endoplasmique rugueux (Env). Les nouveaux virions formés par l’étape d’assemblage acquièrent leur enveloppe par bourgeonnement de la membrane cytoplasmique et sont libérés. Dans les virions, la protéase (P) virale assure enfin la maturation des protéines Gag et Gag-Pol par clivages protéolytiques avec la formation de particules virales infectieuses (figure III.10.2).
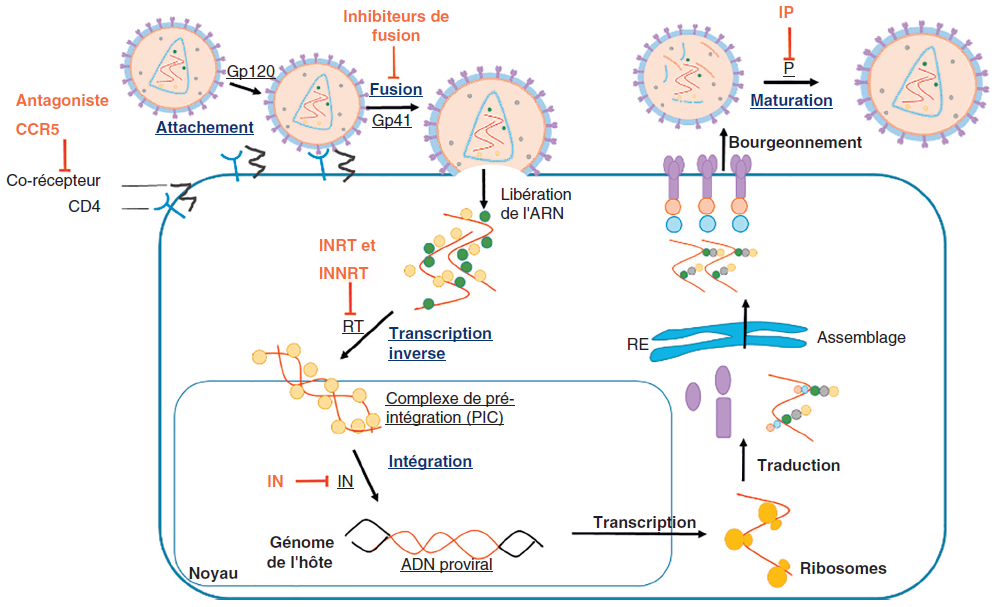
Les antiviraux (en rouge) ciblant différentes protéines virales (soulignées) et étapes clés du cycle viral (en gras). INTI = inhibiteurs nucléos(t)idiques de la transcriptase inverse ; INNTI = inhibiteurs non nucléosidiques de la transcriptase inverse ; II = inhibiteurs de l’intégrase ; IP = inhibiteurs de protéase, IA = inhibiteurs de l’attachement (agoniste de CCR5, inhibiteur de la fixation Gp120-CD4), IF = inhibiteur de la fusion.
| Points clés L’entrée du virus est médiée par une interaction Gp120-CD4 + corécepteur. En plus des protéines d’enveloppe, les protéines majeures du cycle viral sont la RT, l’intégrase et la protéase. |
DONNÉES ÉPIDÉMIOLOGIQUES
En 2020, le HIV-1 infectait 35 millions d’individus dans le monde et a été responsable de 700 000 décès. En France, on estime à 180 000 le nombre de personnes vivant avec le HIV dont environ 25 000 qui n’ont pas connaissance de leur statut. L’incidence est stable et estimée à 6 000 nouvelles contaminations par an, principalement par rapports sexuels non protégés (majoritairement par coït anal impliquant des hommes ayant des rapports sexuels avec des hommes, HSH ; et hétérosexuels), moins fréquemment par exposition au sang (quasi exclusivement usagers de drogues injectables) et très rare (< 1–2 % des grossesses de mère HIV +) par transmission mère-enfant en France, du fait de la prophylaxie très efficace (les cas de transmission sont liés à l’absence de prise en charge pendant la grossesse ou à des résistances importantes aux antirétroviraux).
À noter que le HIV-2 est rare en France (environ 1 % des infections) étant présent quasi exclusivement dans sa région d’émergence, l’Afrique de l’Ouest.
| Points clés Le HIV se transmet par rapports sexuels non protégés (HSH ++), par le sang, ou de la mère à l’enfant en absence de prophylaxie. |
PHYSIOPATHOLOGIE ET MANIFESTATIONS CLINIQUES
L’infection par le HIV débute par une phase d’incubation de 10–15 jours (asymptomatique) suivie par une phase de primo-infection puis une phase d’infection a- ou paucisymptomatique. En l’absence de traitement, l’infection évolue vers le stade SIDA et le décès en 8 ans en moyenne (figure III.10.3).
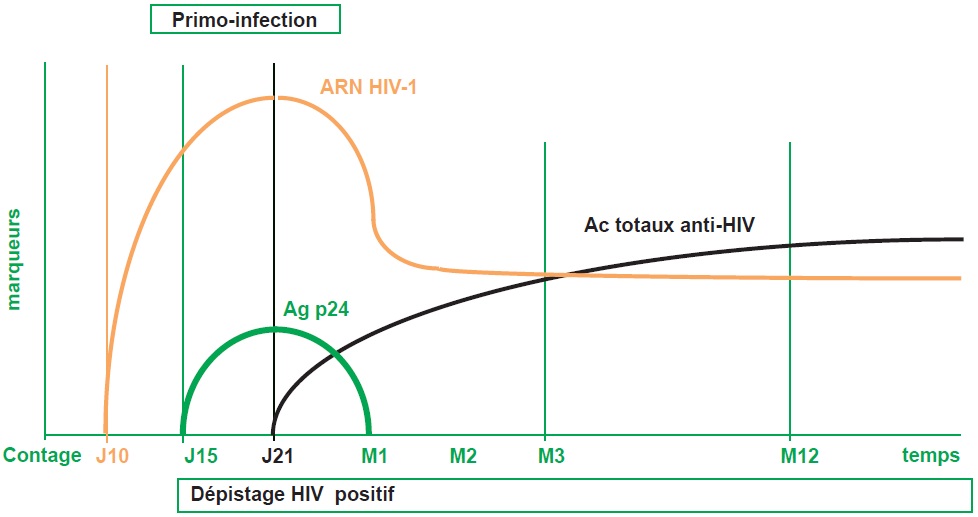
Ac : anticorps ; Ag : antigène ; HIV : virus de l’immunodéficience humaine.
PRIMO-INFECTION
Clinique : asymptomatique ou pharyngite avec syndrome pseudo-grippal peu marqué (asthénie, fièvre, céphalées, adénopathies, pharyngite) pouvant être associés à d’autres symptômes (gastro-intestinaux, neurologiques, éruption…).
Biologie : syndrome mononucléosique sanguin fréquente possible thrombopénie, leuconeutropénie, lymphopénie transitoire puis hyperlymphocytose CD8 +, cytolyse hépatique (ALAT [alanine aminotransférase] augmentée).
Marqueurs viraux : ARN HIV-1 détectable en moyenne à J10 post-contage, dépistage HIV positif à J15 (Ag P24 détectable à J15 et Ac anti-HIV détectables à J21).
STADE SIDA
Définition : lymphocytes T CD4+ < 200/mm3 avec infections opportunistes et/ou cancers.
Infections opportunistes : cryptococcose, pneumocystose, toxoplasmose, infections à CMV(cytomégalovirus), tuberculose…
Cancers : lymphomes malins non hodgkiniens, lymphome EBV*, cancers à HPV (Human Papillomavirus), maladie de Kaposi…
| Points clés Évolution vers le stade SIDA (CD4 < 200/mm3 avec infections opportunistes et/ou cancers) en l’absence de traitement. |
DIAGNOSTIC
DÉPISTAGE
Le dépistage HIV nécessite l’accord du patient. Il est réalisé sur sérum (ou plasma). Il est recommandé en début de grossesse, chez les patients à risque (hommes ayant des rapports sexuels avec des hommes, patients originaires de zones de forte endémie) et au moins une fois dans la vie chez tout individu.
▶ Ce dépistage repose sur un test sérologique, immuno-enzymatique (de type ELISA [Enzyme Linked Immuno-Sorbent Assay]), quatrième génération, combinant la recherche des Ac (anticorps) anti-HIV-1, anti-HIV-2 et de l’Ag (antigène) P24* (de sensibilité ≤ 2 UI/mL) :
▪ les tests (tous réglementairement commercialisés) détectent l’infection par tous les groupes de HIV-1 ;
▪ ces tests sont très sensibles et peuvent conduire à des faux positifs (nécessité du test de confirmation) ;
▪ dépistage encadré par l’arrêté du 28 mai 2010.
▶ Interprétation des tests de dépistage :
▪ test négatif : absence d’infection sous d’exposition dans les 6 semaines précédentes ;
▪ test positif : doit être confirmé par un Western Blot (WB) ou immunoblot, sur le 1er prélèvement de préférence ;
▪ concernant le test positif :
– confirmation de la spécificité de la réactivité des Ac contre les protéines du HIV et différenciation entre HIV-1 et HIV-2 par le test de confirmation,
– test de confirmation spécifique mais moins sensible (se positive environ 1 semaine après le test de dépistage puis se complète en environ 2 mois en l’absence d’introduction d’un traitement antirétroviral),
– test de confirmation positif (WB) si ≥ 3 Ac détectés dont ≥ 2 contre les protéines d’enveloppe (Gp160, 120 ou 41),
– tout test de dépistage positif doit être confirmé sur un 2e prélèvement,
– tout dépistage confirmé positif doit faire l’objet d’une déclaration obligatoire anonymisée à l’ARS (agence régionale de santé),
– un test de dépistage positif, non confirmé par un immunoblot positif doit faire l’objet d’une détection de l’ARN HIV-1 sur le même prélèvement.
▶ En complément, des tests rapides d’orientation diagnostic (TROD) et des autotests HIV sont disponibles :
▪ tests immunochromatographiques recherchant les Ac anti-HIV-1 et 2 (et pour certains l’Ag P24) ;
▪ intérêt : dépistage associatif, urgence, pays à ressources limitées ;
▪ doit être confirmé par un test de dépistage en laboratoire si positif.
▶ Cas particulier du diagnostic chez le nouveau-né :
▪ détections de l’ARN plasmatique du HIV par RT-PCR (Reverse Transcriptase-Polymerase Chain Reaction) ou de l’ADN proviral par PCR (Polymerase Chain Reaction) jusqu’à 6 mois post-arrêt du traitement ;
▪ Sérologie inutile jusqu’à 16-24 mois car les Ac maternels sont détectables : diagnostic de séronégativité HIV à 18 mois.
BILAN COMPLÉMENTAIRE
▶ Bilan initial : numération des lymphocytes T CD4 +/CD8 +, charge virale HIV-1 par Reverse Transcription (RT)-qPCR (quantification de l’ARN HIV-1 plasmatique), génotypage de résistance (séquençage des gènes codant les cibles des antiviraux RT/protéase/intégrase et du gène de l’enveloppe pour recherche de mutations associées à la résistance), recherche d’autres IST (HBV, syphilis…) et co-infections (M. tuberculosis, hépatites virales…).
▶ Bilan de suivi : charge virale HIV-1, numération des lymphocytes T CD4 +/CD8 +, génotypage de résistance aux antirétroviraux, suivi thérapeutique pharmacologique, suivi métabolique/cardiologique, éducation thérapeutique…
| Points clés Sérologie combinée recherchant les Ac anti-HIV-1, anti-HIV-2 et l’Ag p24. Attention à la fenêtre sérologique de 2 semaines environ. À confirmer par test Western Blot HIV ou immunoblot et par dépistage sur un 2nd prélèvement. |
TRAITEMENT ANTIRÉTROVIRAL (ARV)
Le traitement antirétroviral est indiqué chez tous les sujets infectés quel que soit leur nombre de lymphocytes T CD4 +. Il consiste en une multithérapie, le plus souvent une trithérapie. Les objectifs du traitement sont au nombre de 4 :
1) virologique : blocage le plus complet possible de la réplication virale : objectif = charge virale HIV-1 < 50 copies/mL de plasma. Le succès thérapeutique est défini par l’obtention d’une charge virale plasmatique inférieure à 50 copies/mL en un maximum de 6 mois ;
2) immunologique : maintenir l’immunocompétence du sujet : objectif = lymphocytes T CD4+ > 500/mm3 ;
3) clinique : sujet asymptomatique, sans pathologie opportuniste ;
4) santé publique : bloquer la transmission du HIV-1.
Indications de traitement : infection par le HIV, quel que soit le taux de lymphocytes T CD4+. Si les lymphocytes T CD4+ sont < 200/mm3, initiation rapide sous prophylaxie des infections opportunistes (cotrimoxazole).
Stratégie thérapeutique pour un premier traitement : trithérapie par voie orale associant 2 inhibiteurs nucléos(t)idiques de la transcriptase inverse INTI (TDF/TAF + FTC ou ABS + 3TC) avec 1 inhibiteur non nucléos(t)idique de transcriptase inverse INNTI (RPV) ou 1 inhibiteur d’intégrase II (RAL/BIG/EVG) ou 1 inhibiteur de protéase IP (DRV/rtv). Possibilité de traitement en 1 comprimé (« associations fixes ») et 1 prise par jour.
L’efficacité du traitement antirétroviral est confirmée par la mesure de la charge virale plasmatique HIV-1 (éventuellement HIV-2 pour les patients infectés par HIV-2) et par la mesure du nombre de lymphocytes T CD4 + et la clinique.
Le traitement des pathologies opportunistes est prioritaire sur l’initiation du traitement antirétroviral. La pathologie opportuniste doit être éradiquée ou sous contrôle, sinon il y a un risque de syndrome de reconstitution immune (SRI) à l’initiation du traitement antirétroviral avec aggravation des signes cliniques. La prévention par cotrimoxazole de la toxoplasmose et de la pneumocystose est systématiquement initiée lorsque les lymphocytes T CD4 + sont < 200/mm3.
Si non-réponse virologique ou échappement confirmé par une charge virale détectable : éducation thérapeutique et dosage sanguin des antirétroviraux (ARV), génotypage de résistance (séquençage des gènes codant les cibles des ARV), adaptation du traitement en fonction de l’historique (décision multidisciplinaire : infectiologue, pharmacologue, virologue…).
PRÉVENTION
La prévention repose sur :
▶ la réduction des pratiques à risque et l’information :
▪ sexuelle : rapports sexuels protégés (préservatifs masculin ou féminin), éviter le multipartenariat,
▪ toxicomanie intraveineuse : seringues à usage unique ;
▶ le dépistage large et incitatif ; gratuit et anonyme en centre gratuit d’information de diagnostic et dépistage (CeGIDD) ;
▶ le traitement pour prévenir la transmission : Treatment as Prevention (TasP = traitement de l’ensemble des sujets infectés par le HIV) ;
▶ le traitement préexposition (chez des sujets à risque élevé d’infection) : Pre Exposure Prophylaxis (PrEP) composé de ténofovir + emtricitabine ;
▶ la sécurisation virale des dons de cellules, tissus (transfusion et produits sanguins) et organes ;
▶ maladie à déclaration obligatoire anonyme (dépistage HIV + et immunoblot HIV +) ;
▶ la prévention de la transmission mère-enfant (TME) : traitement antirétroviral compatible avec une grossesse, perfusion de zidovudine (AZT) ou ténofovir (TDF/TAF) pendant le travail et traitement post-exposition (TPE) du nouveau-né, allaitement maternel proscrit ;
▶ cas particulier de l’accident d’exposition sexuelle et au sang (AES), évaluation médicale du risque de transmission dépendant du statut du sujet source et de la blessure :
▪ dépistage HIV en urgence chez le patient source (si le statut n’est pas connu + dépistage HBV et HCV) ;
▪ évaluation de l’indication de traitement post-exposition TPE ;
▪ si TPE : à débuter le plus tôt possible, idéalement dans les 4 h (maximum dans les 48 h) et pour une durée de 4 semaines ;
▪ déclaration à la médecine du travail dans les 48 h pour suivi biologique du sujet exposé.
| Points clés Le traitement du HIV repose en 1re ligne sur une trithérapie associant 2 INTI + 1 II/IP/INI/INNTI. La prévention repose sur la réduction des risques, le dépistage et le traitement (TasP, TPE, PrEP). |
