Streptococcus agalactiae, le streptocoque bêtahémolytique du groupe B, est un pathogène important qui constitue la première cause d’infection bactérienne materno-foetale dans les pays industrialisés. Il est également responsable d’infections invasives chez l’adulte (bactériémies, méningites, infections ostéo-articulaires).
CARACTÉRISTIQUES BACTÉRIOLOGIQUES
TAXONOMIE
Embranchement des Firmicutes, famille des Streptococcaceae, genre Streptococcus.
MORPHOLOGIE, CARACTÈRES CULTURAUX ET D’IDENTIFICATION
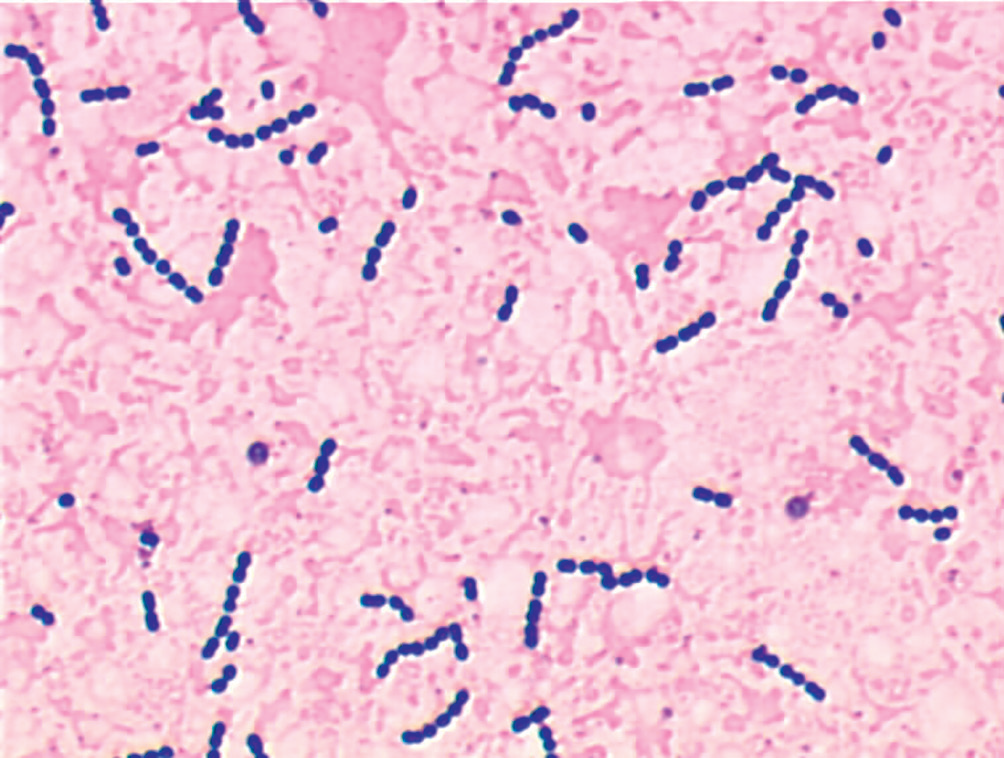
Les S. agalactiae sont des cocci à Gram positif, immobiles et non sporulés, se présentant généralement sous forme de diplocoque ou de courtes chainettes (figure II.16.1).
Comme les autres streptocoques, le type respiratoire est anaérobie aéro-tolérant et la réaction de catalase est négative.
S. agalactiae est exigeant (croissance sur gélose au sang). L’hémolyse sur gélose au sang frais est totale. Ce streptocoque bêtahémolytique possède un polyoside C responsable d’une agglutination en B selon la classification de Lancefield. Une majorité de souche est pigmentée (pigment orangé sur milieu Granada). L’hémolyse et la pigmentation sont indissociables.
À quelques rares exceptions, les isolats cliniques sont capsulés. Dix sérotypes capsulaires sont définis selon l’organisation du polyoside capsulaire (Ia, Ib, II à IX).
FACTEURS DE VIRULENCE
Les facteurs de virulence majeurs de S. agalactiae sont la capsule et une hémolysine. Certains clones caractérisés par Multi Locus Sequence Typing (MLST) présentent des facteurs de virulence particuliers. C’est le cas du sequence type 17 (ST 17), considéré comme hypervirulent.
DONNÉES ÉPIDÉMIOLOGIQUES
En France, il est estimé annuellement qu’un peu plus de100 méningites (très majoritairement néonatales) et 3 000 bactériémies isolées sont dues à S. agalactiae (Santé publique France, données 2019). L’incidence est élevée chez le jeune enfant et chez le sujet âgé.
PHYSIOPATHOLOGIE ET MANIFESTATIONS CLINIQUES
HABITAT
S. agalactiae est une bactérie commensale du microbiote digestif présent au niveau vaginal chez 10 à 30 % des femmes (portage asymptomatique).
PHYSIOPATHOLOGIE
La physiopathologie des infections materno-foetales est due le plus fréquemment à une contamination lors de l’accouchement par voie basse par ingestion/inhalation de sécrétion vaginale contaminée au moment du passage de la filière génitale colonisée par S. agalactiae.
Une contamination par voie ascendante (in utero) après rupture des membranes et en cas de prématurité est possible de même qu’une contamination après la naissance par l’allaitement.
On considère que 50 % des enfants nés de mères hébergeant S. agalactiae seront colonisés et que 1 à 2 % d’entre eux développeront une infection.
La physiopathologie des infections néonatales précoces (survenant dans les 7 premiers jours de vie) est liée à l’inhalation des sécrétions génitales maternelles.
La physiopathologie des infections néonatales tardives (survenant après le 7e jour et jusqu’au 3e mois) fait suite à l’ingestion et à une translocation digestive.
Les infections de l’adulte sont à point de départ cutané, digestif ou encore gynécologique.
PRINCIPALES MANIFESTATIONS CLINIQUES
Infections materno-foetales (contamination du nouveau-né à la naissance) :
▶ Infections précoces :
▪ bactériémies ++ ;
▪ pneumonies ++ ;
▪ méningites +.
▶ Infections tardives : méningites +++.
▶ Infections de l’adulte :
▪ infections du post-partum, urinaires ;
▪ arthrites, péritonites, bactériémies, méningites, pneumonies.
| Points clés ● S. agalactiae est un pathogène majeur dans les infections bactériennes materno-foetales et dans les infections invasives du sujet âgé. ● La fréquence du portage vaginal est de 10 à 30 %. |
DIAGNOSTIC
DIAGNOSTIC DIRECT
Deux situations peuvent être rencontrées ; le dépistage du portage vaginal chez la femme enceinte qui est recommandé entre la 34e et la 38e semaine d’aménorrhée (SA) ou le diagnostic d’une infection.
Le dépistage de S. agalactiae chez la femme enceinte est basé sur un écouvillonnage vaginal (éventuellement par auto-prélèvement). Seule une mise en culture sera effectuée sur une gélose Granada incubée en anaérobiose, ou sur une gélose chromogène ou à défaut sur une gélose au sang frais (fin liseré d’hémolyse totale) (figure II.16.2). D’autres milieux peuvent être associés. Le dépistage peut également être effectué par PCR.
Pour le diagnostic d’infection, la stratégie est celle de l’analyse microbiologique de l’échantillon. Pour un nouveau-né suspect d’infection, des hémocultures, des prélèvements respiratoires, ou l’analyse du placenta sont habituellement effectués. S. agalactiae peut être isolé lors d’infections invasives à partir d’hémocultures, de LCR ou plus rarement de liquide articulaire. S. agalactiae est fréquemment isolé de prélèvements génitaux (prélèvement vaginal, endocol) ou d’urines.
L’identification est effectuée par spectrométrie de masse de type MALDI-TOF (Matrix Assisted Laser Desorption Ionisation/Time of Flight). La recherche du groupe B de Lancefield par agglutination peut être effectuée à défaut.

AUTRES MÉTHODES DE DÉTECTION
Un test d’amplification génique (PCR) ciblant un gène spécifique de S. agalactiae peut être effectué à partir d’un prélèvement vaginal dans le cadre du dépistage ou à partir d’échantillons normalement stériles (PCR simplex ou PCR syndromique par exemple, pour le diagnostic d’agent responsable de méningite).
DIAGNOSTIC INDIRECT
Il n’y a pas de diagnostic sérologique.
| Points clés Il existe un dépistage ciblé chez la femme enceinte à partir d’un prélèvement vaginal prélevé entre 34 et 38 SA. |
SENSIBILITÉ AUX ANTIBIOTIQUES ET ANTIBIOGRAMME
S. agalactiae est naturellement sensible à de nombreux antibiotiques. Il n’y a pas de résistance acquise aux bêta-lactamines qui sont considérées comme toujours efficaces (aminopénicillines ou céphalosporines de 3e génération).
Il existe des résistances acquises aux macrolides (proche de 25 %) et aux tétracyclines (80 %). Les glycopeptides conservent leur efficacité.
L’antibiogramme peut être effectué en milieu liquide ou en milieu solide. Dans ce dernier cas, une gélose Mueller-Hinton au sang est utilisée (gélose MH-F [Mueller-Hinton Fastidious Agar]).
TRAITEMENT
Le traitement de choix des infections à S. agalactiae repose en première intention sur l’utilisation des bêta-lactamines et en particulier d’une aminopénicilline. Dans les infections invasives, l’aminopénicilline est utilisée par voie IV. Le céfotaxime peut être utilisé initialement en probabiliste par voie injectable.
La durée de l’antibiothérapie est habituellement de 7 jours pour les bactériémies et 14 jours pour les méningites. Selon les signes de gravité, la gentamicine est associée initialement. En cas d’allergie aux bêta-lactamines et selon le type d’infection, les macrolides (s’il n’y a pas de résistance acquise) ou les glycopeptides peuvent être utilisés.
| Points clés S. agalactiae est sensible aux bêta-lactamines. |
PRÉVENTION
La prévention des infections materno-fœtales à S. agalactiae est basée sur le dépistage du portage vaginal chez la femme enceinte entre 34 et 38 SA.
En cas de positivité du dépistage, une antibioprophylaxie au début du travail (per partum) est recommandée. Une antibioprophylaxie est également recommandée dans les situations suivantes ; enfant antérieur avec infection invasive à streptocoque du groupe B, bactériurie à streptocoque de groupe B durant la grossesse, accouchement < 37 semaines de gestation, rupture des membranes ≥ 18 h, température intra-partum ≥ 38 °C.
Les antibiotiques utilisés sont la pénicilline G ou l’amoxicilline en IV. En cas d’allergie, les macrolides ou lincosamides (érythromycine/ clindamycine) ou la vancomycine peuvent être utilisés.
Il n’existe pas actuellement de vaccin.
| Points clés Dépistage du portage vaginal de S. agalactiae chez la femme enceinte entre 34 et 38 SA dans la perspective de la mise en place d’une antibioprophylaxie per partum par amoxicilline ou pénicilline G. |
