Helicobacter pylori est une bactérie qui colonise la muqueuse de l’estomac de manière chronique, qui est à transmission interhumaine, principalement par voie orale au sein de l’environnement familial. Elle est responsable de différentes pathologies gastroduodénales. C’est la seule bactérie classée comme cancérigène pour l’Homme par l’OMS.
CARACTÉRISTIQUES BACTÉRIOLOGIQUES
TAXONOMIE
H. pylori est une Proteobacteria, appartenant à l’ordre des Campylobacterales et du genre Helicobacter.
MORPHOLOGIE
C’est une bactérie à Gram négatif, incurvée ou spiralée d’environ 3 μm de long et 0,5 μm de diamètre possédant 4 à 6 flagelles polaires (figure II.6.1). Elle est mobile à l’état frais, possède une activité uréasique et des réactions d’oxydase et de catalase positives.
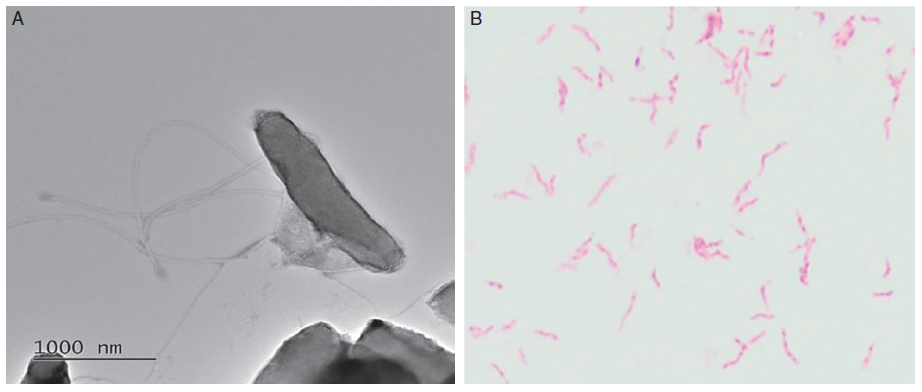
FACTEURS DE VIRULENCE
H. pylori possède de nombreux facteurs de virulence présentés dans le tableau II.6.1.
Tableau II.6.1 Principaux facteurs de virulence d’Helicobacter pylori.

| Points clés ● Helicobacter pylori est une bactérie à Gram négatif, spiralée et flagellée. ● Cette bactérie possède plusieurs facteurs de virulence lui permettant de survivre dans l’acidité gastrique, d’atteindre les cellules épithéliales ou encore d’apporter des modifications cellulaires pouvant induire des pathologies gastriques. |
DONNÉES ÉPIDÉMIOLOGIQUES
L’infection à H. pylori est l’infection bactérienne la plus répandue dans le monde, il est estimé que 50 % de la population mondiale serait infectée. Il existe de grandes disparités géographiques, l’Asie, l’Amérique latine et les pays en voie de développement étant les zones les plus fortement touchées. Entre 15 et 30 % de la population française serait infectée par H. pylori.
PHYSIOPATHOLOGIE ET MANIFESTATIONS CLINIQUES
HABITAT
Le réservoir de cette bactérie est l’estomac des humains. La bactérie est présente dans les vomissures, la salive et les fèces suggérant une transmission gastro-orale, oro-orale et/ou fécale-orale.
PHYSIOPATHOLOGIE
L’infection par H. pylori induit systématiquement une inflammation chronique de l’épithélium gastrique appelée gastrite superficielle. Sans éradication de la bactérie, cette gastrite devient chronique évoluant dans 5 à 10 % des cas en ulcères. Ces ulcères sont dus à la cytotoxicité induite par la bactérie via la libération d’enzymes ou de toxines favorisant une inflammation locale, ainsi qu’à une action indirecte par augmentation de l’acidité gastrique quand l’infection se situe au niveau antral. L’inflammation chronique provoque une gastrite atrophique qui peut évoluer séquentiellement en métaplasie intestinale puis en dysplasie et enfin, dans 1 % des cas, en adénocarcinome gastrique.
L’infection chronique par H. pylori peut également aboutir, dans moins de 1 % des cas, à un lymphome gastrique du MALT (Mucosa associated lymphoid tissue) en raison de l’afflux de lymphoplasmocytes et de la prolifération monoclonale des lymphocytes B de la zone marginale des follicules lymphoïdes.
PRINCIPALES MANIFESTATIONS CLINIQUES
L’infection aiguë et la gastrite associée passent le plus souvent inaperçue, 70 % à 80 % des infections sont asymptomatiques. Les symptômes cliniques décrits sont de la dyspepsie, des épigastralgies, des reflux, des douleurs abdominales mal définies ou des vomissements. La recherche de l’infection à H. pylori est également incluse dans le bilan étiologique des anémies ferriprives ou des carences en vitamine B12.
FACTEURS DE RISQUE
Les facteurs de risque sont principalement la promiscuité et le bas niveau socio-économique.
| Points clés ● L’infection chronique par H. pylori est responsable de différentes pathologies gastriques telles que la gastrite, l’ulcère, le cancer gastrique ou encore le lymphome gastrique du MALT. ● Ces pathologies sont associées à différentes manifestations cliniques telles que des douleurs épigastriques, des reflux, des diarrhées et des vomissements. |
DIAGNOSTIC
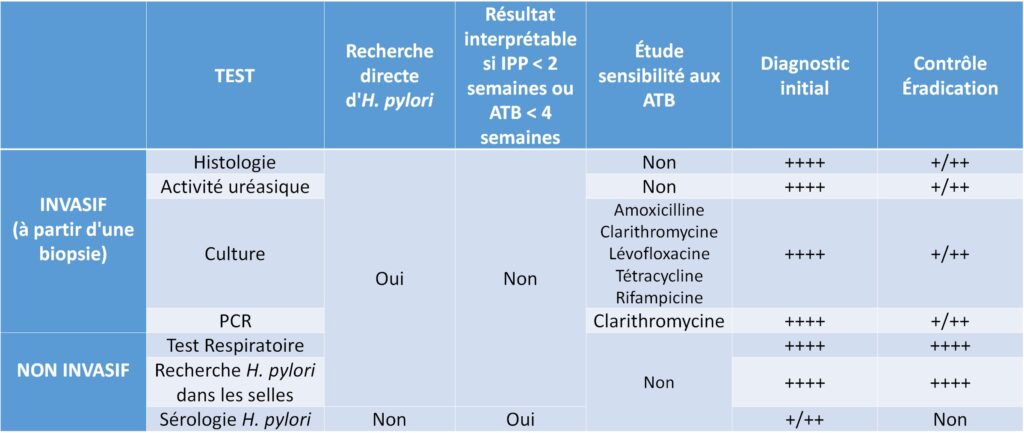
Le diagnostic d’une infection à H. pylori repose sur l’utilisation de tests invasifs ou non invasifs (tableau II.6.2).
Tableau II.6.2 Recommandations de prise en charge diagnostique de l’infection à H. pylori (Groupe d’études français des Helicobacters, GEFH, 2021).
DIAGNOSTIC DIRECT
a) Méthodes invasives
Réalisation, sous endoscopie gastroduodénale, de biopsies ciblées sur les lésions mais aussi sur d’autres zones de l’antre et du fundus. Tout traitement par inhibiteur de pompe à protons (IPP) doit avoir été arrêté depuis 2 semaines et un délai de 4 semaines après l’arrêt de l’antibiothérapie doit être respecté.
Test à l’urée : détection extemporanée de l’activité uréase d’une biopsie par recherche d’une augmentation de pH. Le test rapide à l’urée a une sensibilité acceptable après 1 à 2 h (< 90 %) et une excellente spécificité (95 %).
Examen anatomo-pathologique : permet de mettre en évidence, grâce à différentes colorations (hématéine-éosine-safran, giemsa modifié, acridine…) la présence de H. pylori mais aussi l’étendue des lésions inflammatoires et la présence d’éventuelles lésions cancéreuses.
Culture bactérienne : les biopsies sont broyées puis ensemencées sur un milieu gélosé additionné de 10 % de sang et éventuellement de suppléments sélectifs pour inhiber la croissance de contaminants occasionnels. H. pylori est une bactérie exigeante, l’incubation doit être effectuée en atmosphère microaérobie, humide, à 37 °C. Les primocultures doivent être incubées 10-12 jours avant d’être déclarées négatives. Les souches de H. pylori sont difficilement identifiables par MALDI-TOF (Matrix Assisted Laser Desorption Ionisation/Time of Flight) (scores trop faibles). L’identification de l’espèce est basée sur les critères d’exigence culturale (microaérophilie), l’aspect incurvé ou spiralé au Gram ou à l’état frais, et sur la présence d’une activité uréasique, oxydasique et catalasique.
PCR : permet la détection de H. pylori et l’évaluation de la résistance aux macrolides uniquement. Plusieurs kits commer ciaux sont disponibles. Elle est plus sensible que la culture. Non remboursée en France.
L’endoscopie gastroduodénale est recommandée en 1ère intention pour les patients :
▶ avec symptômes orientant vers une pathologie gastrique tels que syndrome ulcéreux ou dyspepsie chez un patient > 40-45 ans ;
▶ avec symptômes alarmants sans cause trouvée : dysphagie, amaigrissement, anémie ferriprive, carence en vitamine B12 ;
▶ avec facteurs de risque de cancer gastrique : personnes > 40-45 ans apparentées à un patient ayant eu un cancer gastrique ou un lymphome gastrique du MALT ;
▶ ayant une intervention bariatrique prévue.
b) Méthodes non invasives
Test respiratoire à l’urée marquée au 13C : permet de mettre en évidence les infections actives en détectant une activité uréase, par mesure de 13CO2 dans l’air expiré après ingestion d’urée marquée au 13C. Il peut être indiqué en primo-diagnostic ou après traitement pour vérifier l’éradication de la bactérie (6 semaines après l’arrêt du traitement : 2 semaines post-IPP et 4 semaines post-antibiothérapie).
Recherche d’antigènes spécifiques dans les selles : ce sont des tests d’immunocapture permettant la recherche d’infection active et le suivi précoce de l’éradication de la bactérie (15 jours après l’arrêt du traitement). Non remboursée en France.
DIAGNOSTIC INDIRECT
Sérologie : c’est une méthode non invasive permettant la mise en évidence d’IgG spécifiques dans le sérum 2 à 3 semaines après le début de l’infection. Elle n’est pas adaptée au suivi post-éradication car la décroissance des anticorps est très lente. C’est le seul test diagnostic qui n’est pas influencé par la prise d’IPP.
La sérologie est recommandée chez les patients sans symptôme digestif de moins de 40-45 ans :
▶ apparentés à un patient ayant eu un cancer gastrique ;
▶ avec antécédents d’ulcère sans preuve d’éradication de H. pylori ;
▶ avec un purpura thrombopénique immunologique.
En cas de positivité, il est conseillé par l’HAS de pratiquer une endoscopie et une analyse par culture et PCR des biopsies.
| Points clés ● La détection de l’infection par H. pylori peut être effectuée par des tests invasifs ou non invasifs à choisir en fonction des critères du patient et de l’indication : diagnostic initial ou contrôle d’éradication. ● La culture bactérienne nécessite des conditions particulières : milieu enrichi en sang, microaérobiose, atmosphère humide, 37 °C. ● Le diagnostic par PCR permet également de mettre en évidence la résistance ou la sensibilité aux macrolides. |
SENSIBILITÉ AUX ANTIBIOTIQUES ET ANTIBIOGRAMME
Il est recommandé que les antibiogrammes soient réalisés par la détermination des concentrations minimales inhibitrices (CMI) par méthode E-test® ou équivalent. Les milieux utilisés sont des géloses de Mueller-Hinton additionnées de sang et supplémentées de type MH-F (Mueller-Hinton Fastidious Agar).
Les taux de résistance primaire de H. pylori aux antibiotiques en France en 2020 étaient environ de :
▶ clarithromycine : 20 % ;
▶ lévofloxacine : 17 % ;
▶ amoxicilline : < 0,5 % ;
▶ rifampicine : 0 % ;
▶ tétracycline : 0 % ;
▶ métronidazole : 60 %.
La sensibilité aux macrolides peut également être prédite par biologie moléculaire (PCR).
TRAITEMENT
Il est indispensable d’avoir confirmé la présence de H. pylori avant de démarrer tout traitement. Il existe actuellement différents traitements antibiotiques, associés à l’IPP, qui ont pour but d’éradiquer l’infection à H. pylori (tableau II.6.3). Le traitement orienté, basé sur les résultats de l’antibiogramme ou des tests moléculaires prédictifs de la résistance, est à privilégier.
Tableau II.6.3 Recommandations de traitement de l’infection à H. pylori par le groupe d’étude français des Helicobacters (GEFH).
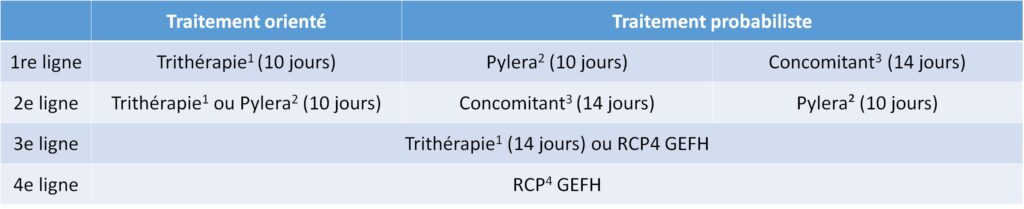
2 IPP (oméprazole) + Citrate de Bismuth + tétracycline + métronidazole. Ce traitement est contre-indiqué pendant la grossesse et chez l’insuffisant rénal ou hépatique.
3 IPP (ésoméprazole ou rabéprazole) + amoxicilline + clarithromycine + métronidazole.
4 Réunion de concertation pluridisciplinaire.
Les IPP administrés à forte dose et de façon prolongée permettent d’augmenter le pH gastrique facilitant l’action des antibiotiques, et d’activer les bactéries quiescentes les rendant ainsi sensibles aux antibiotiques.
Un traitement est indiqué lorsque la présence de H. pylori est mise en évidence dans les situations suivantes :
▶ maladie ulcéreuse duodénale en poussée ;
▶ maladie ulcéreuse gastrique ;
▶ autres contextes : lymphome du MALT, atrophie gastrique, premiers stades de cancer gastrique, résection gastrique, purpura thrombopénique idiopathique, anémie ferriprive inexpliquée, maladies dyspeptiques non ulcéreuses, prise prolongée d’anti-inflammatoires non stéroïdiens, enfants souffrant de douleurs abdominales chroniques.
Le traitement est non recommandé en cas de reflux gastrooesophagien.
Le contrôle de l’éradication doit être effectué systématiquement et au plus tôt 4 semaines après l’arrêt du traitement antibiotique et 15 jours après l’arrêt du traitement par IPP, par test respiratoire ou nouvelles biopsies. La réinfection après traitement reste rare.
PRÉVENTION
Règles d’hygiène pour éviter les infections primaires dans l’environnement intrafamilial. L’éradication de H. pylori est le mode de prévention du cancer gastrique le plus efficace. Il n’existe pas de vaccin commercialisé contre H. pylori.
| Points clés ● Helicobacter pylori est responsable de pathologies gastriques plus ou moins graves, de la gastrite au cancer. ● Le diagnostic initial est basé sur des biopsies gastriques analysées par examen anatomopathologique, culture avec antibiogramme ou PCR. ● Taux important de résistance à la clarithromycine (environ 20 % des souches). ● Le traitement de référence de 1ère intention à privilégier est un traitement orienté sur les résultats de sensibilité notamment aux macrolides. À défaut, une quadrithérapie bismuthée ou une quadrithérapie concomitante pourront être utilisées. ● L’efficacité sera vérifiée par un test respiratoire à l’urée marquée, 4 à 6 semaines après la fin du traitement. |
