Staphylococcus aureus, le staphylocoque doré, est un pathogène majeur responsable en particulier d’infections cutanées, la plupart superficielles, mais également d’infections profondes : bactériémies, endocardites infectieuses, infections ostéo-articulaires… S. aureus possède une coagulase, par opposition aux staphylocoques à coagulase négative.
CARACTÉRISTIQUES BACTÉRIOLOGIQUES
TAXONOMIE
▶ Famille : Staphylococcaceae
▶ Genre : Staphylococcus
MORPHOLOGIE, CARACTÈRES CULTURAUX ET D’IDENTIFICATION
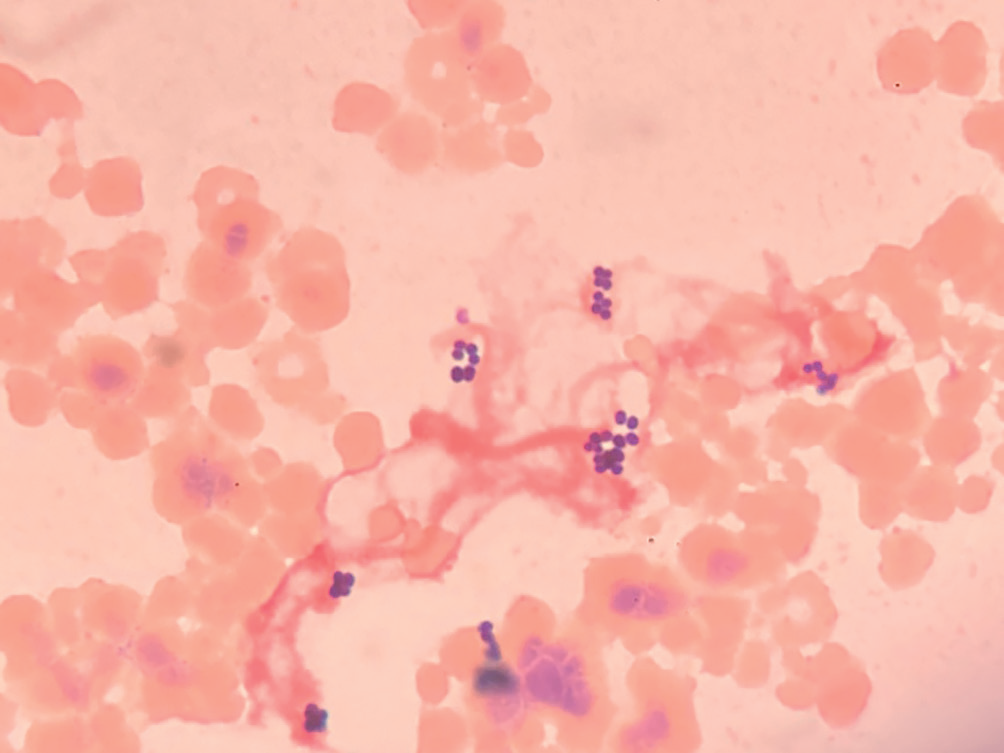
Cocci à Gram positif, immobiles et non sporulés, en amas ou sous forme de tétrades (figure II.15.1).
S. aureus est une bactérie non exigeante et peu fragile, qui croit en atmosphère aérobie et anaérobie.
Réaction de catalase positive. S. aureus élabore un pigment jaune-doré. Hémolyse totale sur gélose au sang. L’halophilie (culture possible en présence de NaCl) et la fermentation du mannitol sont des propriétés pouvant être mises en évidence avec le milieu de Chapman (mannitol + NaCl) qui vire du rouge au jaune en présence de S. aureus.
FACTEURS DE VIRULENCE
S. aureus possède de nombreux facteurs de virulence :
▶ adhésines permettant la colonisation et l’adhésion aux tissus ;
▶ coagulase libre, excrétée et capable de cliver le fibrinogène, responsable d’emboles septiques in vivo ; ▶ coagulase liée ou clumping factor servant de récepteur pour le fibrinogène sur la paroi bactérienne ;
▶ protéine A permettant la liaison aux immunoglobulines ;
▶ hémolysine permettant la lyse des hématies ;
▶ staphylokinase permettant l’activation du plasminogène et la libération des bactéries contenues dans les emboles ;
▶ toxines : leucocidine de Panton et Valentine (PVL) lysant les polynucléaires ; toxine superantigénique du choc toxique staphylococcique (TSST-1), induisant une activation polyclonale des lymphocytes T, exfoliatines, entérotoxines thermostables.
DONNÉES ÉPIDÉMIOLOGIQUES
S. aureus est un pathogène majeur fréquemment responsable d’infections communautaires, cutanées ou à point de départ cutané. S. aureus est par ailleurs le 2e micro-organisme le plus fréquemment responsable d’infections nosocomiales en établissement de santé après E. coli. On le retrouve au 1er rang des micro-organismes isolés dans les infections de la peau et des tissus mous (35 % des cas), les infections du site opératoire (ISO) (24 %), dans les bactériémies nosocomiales (16 %) et les pneumonies (15 %) documentées. Les S. aureus résistants à la méticilline (SARM) représentent 25 % des infections nosocomiales à l’échelle nationale (enquête nationale de prévalence 2017). La prévalence des SARM parmi les souches de S. aureus est de moins de 2 % parmi les souches communautaires.
PHYSIOPATHOLOGIE ET MANIFESTATIONS CLINIQUES
HABITAT
S. aureus est un commensal du microbiote nasal, également retrouvé au niveau oropharyngé, digestif et cutané. Il existe un portage sain permanent ou transitoire chez 20 à 30 % des individus. Il existe un portage animal. La transmission inter-humaine est manuportée ou indirecte (vêtements, surfaces).
PHYSIOPATHOLOGIE
S. aureus est responsable d’infections localisées ou invasives à point de départ cutané. L’origine du S. aureus est endogène (à partir du microbiote du patient) ou exogène. Les infections invasives surviennent après une phase d’invasion à partir d’un foyer cutané d’un site infectieux ou de portage sain. S. aureus peut également exercer son pouvoir pathogène au niveau des muqueuses (rhinopharyngées, vaginales) où son pouvoir infectieux pourra être lié à la production de toxines. Sa capacité à produire du biofilm est à l’origine d’infections chroniques plus difficiles à traiter (infections ostéo-articulaires par exemple). S. aureus peut également produire dans des aliments contaminés des entérotoxines thermostables à l’origine de manifestations digestives.
PRINCIPALES MANIFESTATIONS CLINIQUES
On distingue classiquement les infections suppuratives, les bactériémies et endocardites, les localisations viscérales et les infections toxiniques.
INFECTIONS SUPPURATIVES
▶ Infections cutanées superficielles : furoncles, anthrax (confluence de furoncles), panaris, impétigo croûteux, folliculites, sycosis…
▶ Infections cutanées profondes : dermo-hypodermites, staphylococcie maligne de la face…
BACTÉRIÉMIES, ENDOCARDITES INFECTIEUSES ATTEINTES VISCÉRALES
▶ Abcès profonds.
▶ Ostéo-articulaires (ostéomyélites, arthrites (enfant), spondylodiscites).
▶ Pneumopathies : pneumonies du nouveau-né, pneumonies nécrosantes de l’adulte jeune, infection des patients atteints de mucoviscidose, surinfections chez le patient BPCO (bronchopneumopathie chronique obstructive), ou pneumonies liées aux soins (PAVM [pneumonies acquises sous ventilation mécanique]) en réanimation.
▶ Infections neuro-méningées (abcès, méningites associées aux soins).
INFECTIONS TOXINIQUES
▶ Liées à la production de la PVL :
▪ infections cutanées récidivantes ;
▪ pneumonie nécrosante de l’enfant et l’adulte jeune (tableau associant détresse respiratoire aiguë, hémoptysie et leucopénie, mortelle dans 50 % des cas).
▶ Liées à la production de la TSST-1 : choc toxique avec érythrodermie, avec porte d’entrée vaginale ou cutanée.
▶ Liées à la production d’exfoliatines : syndrome de la peau ébouillantée/d’exfoliation généralisée.
▶ Liées à la production d’entérotoxines : diarrhée 2 à 4 h sans fièvre après ingestion d’aliments contaminés contenant la toxine, toxi-infection alimentaire pouvant être collective (TIAC).
FACTEURS DE RISQUE
Les patients présentant un portage sain sont plus à risque d’infections à S. aureus.
| Points clés S. aureus est un pathogène majeur responsable d’infections cutanées superficielles mais également d’infections invasives, suppuratives et toxiniques. |
DIAGNOSTIC
DIAGNOSTIC DIRECT
Les prélèvements sont liés à la présentation clinique. La physiopathologie de l’infection (processus suppuratif et/ou toxinique) guide la nature des prélèvements à réaliser :
▶ prélèvement local dans les infections cutanées suppuratives et l’impétigo bulleux, à l’écouvillon ou en poudrier ;
▶ hémoculture, prélèvements respiratoires bas et prélèvements profonds (os, tissu, pus…) dans les autres types d’infections suppuratives ;
▶ prélèvements cutanés ou respiratoires bas (selon le tableau clinique) dans les infections à S. aureus sécrétant la LPV (leucocidine de Panton et Valentine) ;
▶ porte d’entrée vaginale, tampons ou prélèvements cutanés selon la porte d’entrée (vaginale ou cutanée) dans les chocs toxiques à S. aureus sécrétant la TSST-1, associés à des hémocultures (généralement négatives si porte d’entrée vaginale, et positives dans 50 % des cas si porte d’entrée cutanée) ;
▶ fosses nasales en cas de syndrome de la peau ébouillantée/ d’exfoliation généralisée (S. aureus absent des lésions, mais présent dans le nez) et pour le dépistage de portage sain et de SARM.
Les diarrhées dues à des S. aureus entérotoxines sont rarement diagnostiquées car d’évolution rapidement favorable. La coproculture est sans intérêt car il s’agit d’une toxi-infection. Néanmoins, les aliments ou le vomi peuvent être analysés à la recherche d’entérotoxine.
EXAMEN DIRECT, CULTURE ET IDENTIFICATION
L’examen direct est réalisé uniquement à partir de produits pathologiques ; il recherche la présence de cocci à Gram positif en amas.
L’identification présomptive des colonies de S. aureus se fait sur plusieurs critères :
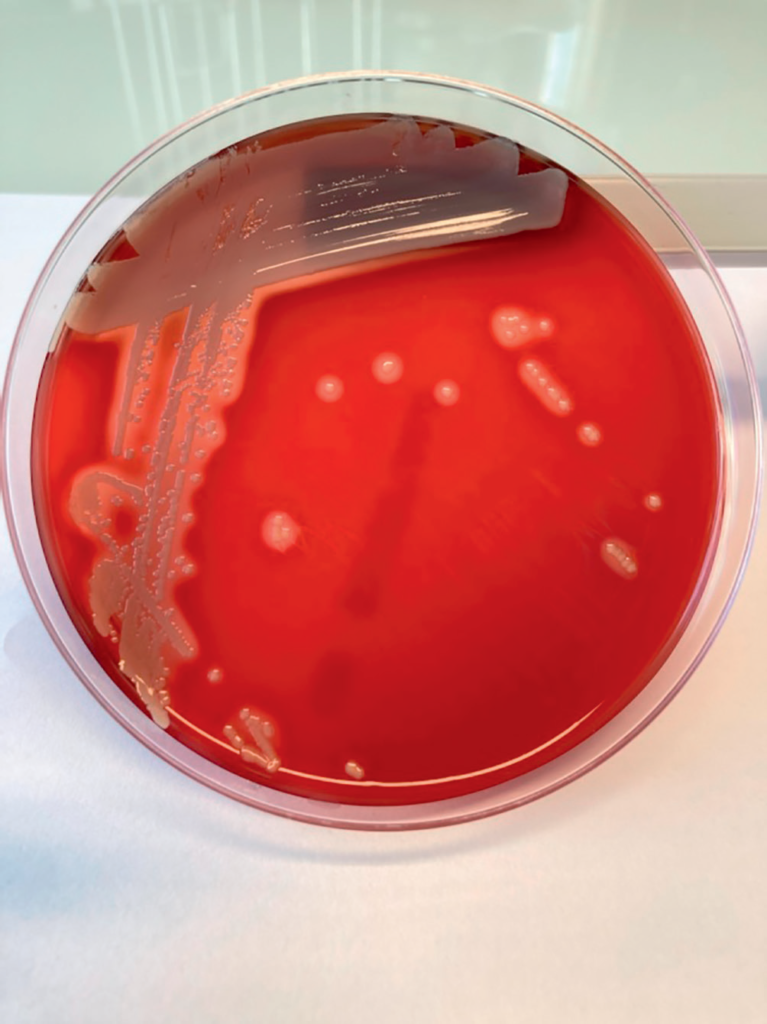
▶ coloration jaune-dorée des colonies, d’où le nom de staphylocoque doré ;
▶ hémolyse totale sur gélose au sang (figure II.15.2) ;
▶ production d’une catalase ;
▶ agglutination permettant la distinction des staphylocoques coagulase négative par mise en évidence de la coagulase liée et de la protéine A.
L’identification formelle d’espèce est aujourd’hui généralement réalisée par spectrométrie de masse de type MALDI-TOF (Matrix Assisted Laser Desorption Ionisation/Time of Flight). La recherche du portage nasal de S. aureus et la recherche de SARM est réalisée à l’aide de milieux gélosés chromogènes.
AUTRES MÉTHODES DE DÉTECTION
▶ Recherche d’ADN génomique par PCR ciblée dans certains prélèvements en cas de culture négative (infections ostéo-articulaires par exemple) et/ou d’antibiothérapie préalable.
▶ Approche syndromique (PCR multiplex) incluant des amorces spécifiques ciblant S. aureus et SARM, par exemple dans les panels hémocultures et les panels respiratoires profonds.
▶ Recherche de gènes de toxines à partir des souches isolées, en particulier PVL et exfoliatines.
DIAGNOSTIC INDIRECT
Pas de diagnostic sérologique réalisé en pratique courante.
| Points clés Le diagnostic d’infection à S. aureus repose principalement sur la mise en culture de prélèvements pathologiques, et dans des cas plus rares (manifestations toxiniques) sur la recherche de portage sain au niveau des fosses nasales. S. aureus est une bactérie peu exigeante, cultivant facilement. Les techniques moléculaires viennent compléter les outils diagnostiques. |
SENSIBILITÉ AUX ANTIBIOTIQUES ET ANTIBIOGRAMME
S. aureus est naturellement sensible à de nombreux antibiotiques.
BÊTA-LACTAMINES
La plupart des souches (90 %) sécrètent une pénicillinase (acquisition d’un gène blaZ plasmidique) qui hydrolyse la pénicilline G, mais également les pénicillines A, V, les uréido- et carboxy-pénicillines. La sensibilité sera restaurée par l’ajout d’un inhibiteur de bêta-lactamase comme l’acide clavulanique. L’association amoxicilline + acide clavulanique est alors active. La sensibilité à la méticilline et aux céphalosporines de 1re génération (céfazoline) est conservée.
La résistance acquise aux pénicillines du groupe M (oxacilline et cloxacilline) (S. aureus résistant à la méticilline = SARM) est liée à l’acquisition du gène mecA ou mecC qui code une PLP (protéine liant les pénicillines) additionnelle (PLP2a ou PLP2c respectivement) présentant une mauvaise affinité pour les bêta-lactamines. Elle induit une résistance à toutes les bêta-lactamines sauf la ceftaroline et le ceftobiprole qui doivent être néanmoins être testés. Elle peut être détectée par un antibiogramme en diffusion (lecture du diamètre de la céfoxitine) ou en milieu liquide (oxacilline et céfoxitine), par une PCR ciblant les gènes mecA/C, par un test immunochromatographique rapide sur colonies détectant la PLP2a/c, ou par milieu chromogène en cas de recherche ciblée de portage de SARM.
AMINOSIDES
S. aureus est naturellement sensible aux aminosides. Une résistance peut être acquise par inactivation enzymatique de l’antibiotique (phospho-, acétyl- ou nucléotidyl-transférases), induisant un profil de résistance isolé à la kanamycine, ou combiné à la tobramycine, ou combiné à la tobramycine et la gentamicine.
GLYCOPEPTIDES ET LIPOPEPTIDES
S. aureus est une bactérie naturellement sensible à la vancomycine, la téicoplanine et la daptomycine. Les résistances sont exceptionnelles.
AUTRES CLASSES D’ANTIBIOTIQUES TESTÉES
S. aureus est naturellement résistant aux quinolones de 1re génération, mais sensible aux fluoroquinolones.
Une résistance acquise aux fluoroquinolones est possible par modification de la cible de l’antibiotique (gyrase et topo-isomérase IV). Une résistance aux fluoroquinolones est fréquemment associée à une résistance à la méticilline, bien que les mécanismes soient indépendants.
Les antibiotiques de la famille MLSK (macrolides, lincosamides, streptogramines et kétolides) sont également actifs sur S. aureus. La résistance acquise est principalement liée à la méthylation de l’ARN ribosomique 23S (gène erm).
Les autres antibiotiques classiquement testés sont : triméthoprime- sulfaméthoxazole, tétracycline, linézolide, rifampicine, acide fusidique, fosfomycine.
| Points clés L’antibiogramme et la détermination de la sensibilité à la méticilline sont indispensables dans les infections à S. aureus. La sensibilité aux antibiotiques antitoxiniques (clindamycine, rifampicine, linézolide) doit être testée en cas d’infection invasive impliquant la LPV ou la TSST-1 (pneumonie nécrosante, choc toxique). |
TRAITEMENT
Le traitement de choix des infections à S. aureus repose en première intention sur l’utilisation des pénicillines M ou la céfazoline pour les infections communautaires et font plus souvent appel aux glycopeptides ou au linézolide en cas de résistance à la méticilline dans les infections invasives associées aux soins.
La prise en charge des infections cutanées superficielles consiste en des soins locaux. Les abcès et les panaris doivent être incisés par des chirurgiens. Un traitement antibiotique est habituellement associé. Les formes graves pourront être traitées par une antibiothérapie per os par amoxicilline – acide clavulanique, pristinamycine (selon l’âge), josamycine ou céphalosporine de 1re génération pendant 7 jours.
Les atteintes tissulaires profondes comme la staphylococcie maligne de la face nécessitent une antibiothérapie par voie parentérale.
Bactériémies : antibiothérapie IV par oxacilline, cloxacilline ou céfazoline si SASM (S. aureus sensible à la méticilline), vancomycine si SARM ; association possible avec un aminoside pour l’obtention d’un effet bactéricide rapide (synergie) les 48 premières heures.
Endocardite infectieuse : traitement IV par pénicilline M (si SASM), ou vancomycine ou daptomycine (si SARM) à forte posologie (ajout de gentamicine et de rifampicine si valve prothétique). La durée totale de traitement est de 4 à 6 semaines.
Pneumopathies : amoxicilline – acide clavulanique si SASM. L’antibiothérapie sera adaptée à l’antibiogramme et à la diffusion de l’antibiotique.
Dans le cas d’un mécanisme toxinique, ajout initial d’un antibiotique bloquant la synthèse toxinique : clindamycine, ou en 2e intention en fonction de l’antibiogramme, linézolide ou rifampicine.
PRÉVENTION
INFECTIONS COMMUNAUTAIRES
▶ Prévention de la transmission intrafamiliale (impétigo, furoncles) par le maintien des ongles courts, une bonne hygiène des mains, le non-partage du linge, des lessives à 60 °C, et une limitation de la macération.
▶ Décontamination nasale des porteurs par mupirocine pommade nasale (en cas de furoncles récidivants).
▶ Déclaration obligatoire des TIAC.
INFECTIONS NOSOCOMIALES
▶ Hygiène des mains +++ (solution hydroalcoolique).
▶ Précautions complémentaires « contact » des patients porteurs de SARM.
▶ Bon usage des antibiotiques.
▶ Antibioprophylaxie précédant une chirurgie cardiaque ou orthopédique par céphalosporine de 1re ou 2e génération.
| Points clés L’évaluation de la sensibilité aux antibiotiques doit être réalisée pour toute souche isolée d’infection. Le traitement de référence d’un SASM est une pénicilline M ou une céphalosporine de 1re génération. La prévention des infections à S. aureus repose principalement sur des mesures d’hygiène. |
