Le cytomégalovirus (CMV) est un virus ubiquitaire pouvant infecter uniquement l’Homme. Le plus souvent responsable d’infections asymptomatiques chez les sujets immunocompétents, il peut causer des infections congénitales malformatives et des maladies graves chez les personnes immunodéprimées.
CARACTÉRISTIQUES VIROLOGIQUES
TAXONOMIE
Famille des Orthoherpesviridae, anciennement famille des Herpesviridae, sous-famille Betaherpesvirinae, genre Cytomégalovirus, espèce cytomégalovirus humain (nom officiel Human betaherpesvirus 5).
STRUCTURE DU VIRUS
Les virions sont formés d’un ADN (acide désoxyribonucléique) double brin linéaire protégé par une capside icosaédrique, elle-même entourée d’un tégument et enfin d’une enveloppe dans laquelle sont enchâssées les glycoprotéines virales.
NUCLÉOCAPSIDE
Le génome du CMV est un ADN bicaténaire linéaire d’environ 240 000 paires de bases, ce qui lui permet d’avoir 35 à 40 protéines de structure et de coder plus de 200 protéines différentes. Il est composé de deux régions uniques, une longue que l’on nomme UL et une courte, que l’on nomme US (pour short). Le génome peut se circulariser dans la cellule grâce à des séquences répétées inversées terminales et constitue alors un épisome. La capside du cytomégalovirus (CMV) est de forme icosaédrique, composée de 162 capsomères.
TÉGUMENT
La nucléocapside est entourée d’une couche, appelée tégument, qui est composée d’un grand nombre de protéines. Les protéines virales qui le composent sont des protéines majoritairement phosphorylées ayant un rôle dans les premières étapes du cycle viral et/ou dans les étapes plus tardives. La protéine codée par UL83 (pp65) est la protéine du tégument la plus abondante dans la particule virale.
ENVELOPPE VIRALE
L’enveloppe est composée d’une double couche de phospholipides provenant des membranes cellulaires, et une douzaine de glycoprotéines transmembranaires virales y sont enchâssées. L’enveloppe confère à la particule virale une sensibilité particulière aux solvants des lipides, au pH acide et à la chaleur.
TROPISME ET RÉPLICATION
Le cytomégalovirus a un tropisme pour de nombreux types cellulaires in vivo : fibroblastes, cellules épithéliales, cellules endothéliales, macrophages, monocytes ou encore des neurones. Au laboratoire, ce sont essentiellement des fibroblastes humains primaires ou immortalisés qui sont utilisés pour la culture in vitro. Le CMV n’infecte pas les cellules non humaines. Le cycle de multiplication du CMV est lent (plusieurs jours) et l’effet cytopathique est un arrondissement et un élargissement important des cellules, ce qui lui a valu son nom (cyto– la cellule et megalo-grosse). Après entrée du virus dans la cellule, la nucléocapside est acheminée à la membrane nucléaire et le génome pénètre dans le noyau, où il se circularise. Les gènes viraux sont transcrits et traduits selon trois vagues successives et coordonnées : très précoce, précoce et tardive. La réplication du génome a lieu dans le noyau, grâce à l’ADN polymérase virale, selon le modèle du cercle roulant. Les nouveaux génomes viraux sont encapsidés dans le noyau, avec la participation du complexe terminase. L’acquisition de l’enveloppe virale définitive se fait dans le cytoplasme, au sein d’un compartiment d’assemblage suite à un remodelage majeur des membranes des organites. Le virus sort ensuite de la cellule par exocytose. Le cytomégalovirus persiste sans se répliquer dans les cellules à l’état latent comme tous les autres membres de la famille. Les cellules réservoirs connues du CMV sont les cellules souches hématopoïétiques CD34 + et les progéniteurs myéloïdes. Il n’y a pas d’intégration du génome viral dans le génome cellulaire, il reste sous forme épisomale. Lors de la réactivation, la transcription du génome aboutit à la production de nouvelles particules virales.
| Points clés Le cytomégalovirus est un virus à ADN enveloppé strictement humain de la famille des Orthoherpesviridae. Son cycle de multiplication, à la fois nucléaire et cytoplasmique, est lent et se déroule en trois phases : très précoce, précoce et tardive. Le CMV persiste à l’état latent mais peut se réactiver. |
DONNÉES ÉPIDÉMIOLOGIQUES
MODES DE TRANSMISSION
Les infections sont endémiques et surviennent tout au long de l’année. La transmission du virus se fait par contact direct avec des fluides biologiques. Le CMV est présent dans le sang et excrété dans la salive, le mucus nasal, les sécrétions cervicovaginales, le sperme, les urines et le lait maternel. La transmission peut se faire au cours de la grossesse, par passage du CMV au travers de la barrière placentaire, suite à une virémie chez la femme enceinte. Il existe aussi une transmission iatrogène, essentiellement lors des transplantations d’organe solide ou après allogreffe de cellules souches hématopoïétiques (CSH).
PRÉVALENCE DANS LE MONDE ET EN FRANCE
La proportion de personnes ayant des anticorps dirigés contre le CMV (séroprévalence) et donc hébergeant le virus à l’état latent (latence systématique), augmente avec l’âge et est en lien avec les conditions socio-économiques et l’origine ethnique. Dans les pays en développement à faible revenu, l’infection par le CMV se produit dans les premières années de vie. À l’âge adulte, la séroprévalence y atteint 90 à 100 %. Dans les pays industrialisés, on observe 2 pics d’incidence : au cours de la petite enfance et chez le jeune adulte. La séroprévalence est inférieure à 50 % chez les femmes en âge de procréer et peut atteindre 80 % dans la population âgée. Une faible prévalence augmente le risque de primo-infection CMV au cours de la grossesse et, ainsi, le risque d’infections congénitales graves à la suite d’une transmission materno-fœtale.
| Points clés Les modes de transmission sont nombreux en raison de la présence du virus dans de nombreux fluides biologiques. Les transmissions materno-fœtale et iatrogène peuvent être impliquées dans des infections graves, respectivement chez le fœtus et le patient immunodéprimé. La prévalence est très élevée dans les pays à faible revenu, avec une acquisition du virus dans les premières années de vie. Elle est bien plus faible dans les pays industrialisés, aux alentours de 50 % des adultes. |
PHYSIOPATHOLOGIE ET MANIFESTATIONS CLINIQUES
HISTOIRE NATURELLE
L’histoire naturelle de l’infection débute par une primo-infection, suivie par une virémie, entraînant une diffusion dans de multiples organes, avant que le virus ne débute une phase de latence (figure III.1.1). Le génome viral persiste (latence) pour le reste de la vie de l’individu infecté, essentiellement dans les cellules mononucléées du sang et dans les cellules endothéliales.
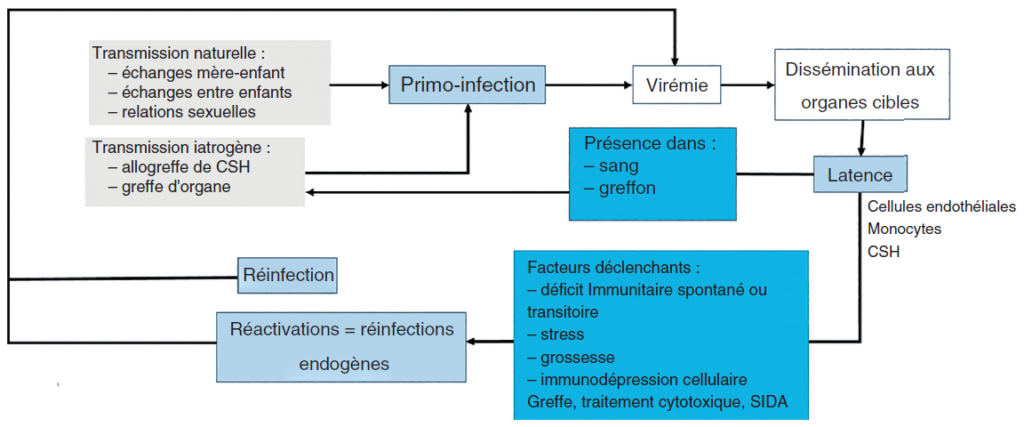
Les épisodes réguliers de réactivations peuvent se produire, à la faveur d’un déficit immunitaire, à l’occasion d’un stress, d’une autre infection ou de la grossesse. Ils peuvent être asymptomatiques ou conduire à des pathologies graves, voire létales (maladies à CMV), peuvent se produire en cas d’immunodépression, suite à un épisode de réactivation important non contrôlé. La réinfection d’un individu par une nouvelle souche virale est également possible. L’excrétion virale (et donc le risque de transmission entre individus) est importante en phase de primo-infection ou de réactivation, lorsque la multiplication virale est active, mais théoriquement nulle en phase de latence.
PRÉSENTATION CLINIQUE
SUJETS IMMUNOCOMPÉTENTS
L’infection et les réactivations sont asymptomatiques dans la majorité des cas. La primo-infection peut entraîner une fièvre persistante (syndrome pseudo-grippal, splénomégalie) accompagnée d’un syndrome mononucléosique sanguin (lymphocytes hyperbasophiles).
Très rarement : cytolyse hépatique, syndrome de Guillain-Barré.
INFECTIONS CONGÉNITALES
L’infection par le CMV est la première cause d’infection congénitale.
Dans le cas d’une primo-infection chez la femme enceinte, le virus est transmis au fœtus dans 30 % des cas. Dans le cas d’une réactivation ou d’une réinfection, le virus est transmis dans moins de 1 % des cas, car les virions présents dans le sang sont généralement neutralisés par le système immunitaire.
Les conséquences de l’infection congénitale varient en fonction du stade de développement du fœtus : retard de croissance intra-utérin (RCIU), malformations notamment cérébrales (calcifications intracrâniennes), voire mort in utero (MFIU). Les séquelles neurosensorielles (essentiellement surdité) sont généralement évolutives et peuvent affecter des nouveau-nés infectés mais asymptomatiques à la naissance.
INFECTIONS CHEZ LES PERSONNES IMMUNODÉPRIMÉES
Le CMV représente, en l’absence de prophylaxie médicamenteuse, la première cause d’infection virale survenant dans les 6 premiers mois après une allogreffe de CSH , transplantation d’organe solide et chez les patients infectés par le HIV (virus de l’immunodéficience humaine) présentant un taux de lymphocytes T CD4 + très bas.
Le syndrome viral associe fièvre et leucopénie, et est observé surtout chez le sujet transplanté d’organe solide. La maladie à CMV (infection associée à des atteintes d’organes) se présente le plus souvent sous forme de rétinites ou de colites chez les patients HIV+, de pneumopathies interstitielles chez le receveur de CSH. L’infection par le CMV peut entraîner le rejet de la greffe, voire la mort du patient.
| Points clés L’infection à CMV est la plus fréquente des infections congénitales. Ses conséquences pour le foetus et le nouveau-né sont potentiellement graves (décès in utero, retard de croissance intra-utérin [RCIU], atteintes neurosensorielles…). Le CMV peut aussi causer de graves pathologies au cours des allogreffes (CSH ou organe solide). Tous les organes peuvent être touchés et le pronostic vital peut être engagé. |
DIAGNOSTIC
Le diagnostic n’est jamais clinique. Dans le cadre des infections materno-fœtales, des anomalies à l’échographie doivent faire rechercher la présence du CMV chez la femme enceinte, puis chez son fœtus. Chez les patients greffés, un suivi virologique sera nécessaire systématiquement après la greffe.
DIAGNOSTIC DIRECT
La détection ou la quantification du génome du CMV est réalisée par PCR (Polymerase Chain Reaction) en temps réel. La quantification du génome viral dans le sang permet de mesurer la charge virale. La présence du CMV sera recherchée dans le sang chez la femme enceinte, dans le liquide amniotique chez le fœtus et dans la salive et/ou les urines chez le nouveau-né.
DIAGNOSTIC INDIRECT
La recherche des IgG (immunoglobuline G) et des IgM contre le CMV se fait par une technique ELISA (Enzyme Linked Immuno-Sorbent Assay). La présence d’IgM spécifiques ne signe pas obligatoirement une primo-infection car elles peuvent aussi être présentes au cours d’une réactivation. La mesure de l’avidité des IgG est utilisée pour faire la distinction entre une primo-infection (avidité faible) et une infection ancienne (avidité forte). Un indice d’avidité élevé permet d’exclure une primo-infection récente.
Le statut sérologique des receveurs et des donneurs d’organes et de CSH est systématiquement recherché avant la greffe.
Le dépistage systématique du CMV pendant la grossesse n’est pas recommandé actuellement. La recherche d’une séroconversion pourra être faite en cas de signes d’appel échographiques au cours du suivi de grossesse. En cas de doute, une mesure d’avidité peut aider à déterminer la période où a eu lieu la séroconversion.
| Points clés Le diagnostic virologique est réalisé par détection/ quantification du génome viral par PCR en temps réel. Les techniques quantitatives permettent de mesurer la charge virale dans le sang. La sérologie permet de connaître le statut sérologique avant la greffe du donneur et du receveur. Une séroconversion permet de mettre en évidence une primo-infection mais la mesure de l’avidité des IgG peut aussi y contribuer. |
TRAITEMENT
Plusieurs antiviraux contre le CMV (ganciclovir, foscarnet…) inhibent l’activité de l’ADN polymérase virale pUL54.
Le ganciclovir est un analogue nucléosidique de la guanosine qui doit être triplement phosphorylé (bioprécurseur) pour être actif et dont la première phosphorylation est faite par une enzyme virale pUL97.
Le valganciclovir, une prodrogue à administrer par voie orale, est un ester L-valine du ganciclovir.
Le foscarnet inhibe pUL54 sans phosphorylation préalable.
Le maribavir cible la phosphotransférase pUL97, entraînant une accumulation des nucléocapsides dans le noyau.
Le létermovir agit sur l’étape d’encapsidation du génome, en interagissant avec le complexe terminase (pUL56, pUL89 et pUL51).
Le ganciclovir par voie IV est utilisé en traitement d’attaque chez les personnes greffées immunodéprimées pendant 2 à 4 semaines. Un relai par le valganciclovir par voie orale pendant plusieurs mois réduit le risque de rechutes. En cas de résistance au ganciclovir (le plus souvent causée par mutation de la pUL97), le traitement se fait par foscarnet, également par voie IV. Le ganciclovir possède une toxicité hématologique importante (neutropénie) alors que le foscarnet est néphrotoxique. Le ganciclovir est tératogène et ne peut donc pas être administré à la femme enceinte. En revanche, on peut administrer du valaciclovir à la femme enceinte lors d’une primo-infection afin de réduire la transmission du CMV au fœtus.
| Points clés Le ganciclovir est un analogue nucléosidique inhibiteur de l’ADN polymérase virale. Il est utilisé en première intention dans le traitement curatif, puis le valganciclovir, sa prodrogue administrable par voie orale, est utilisé en relai. Le foscarnet est une alternative thérapeutique en cas de résistance ou lors d’atteinte de la moelle osseuse. |
PRÉVENTION
Il n’existe pas de vaccin pour prévenir l’infection par le CMV.
PRÉVENTION DE L’INFECTION ET DE LA MALADIE À CMV POST-GREFFE
L’instauration de traitements prophylactiques (avant que le virus se multiplie) et de traitements préemptifs (lors de la réactivation virale mais avant maladie à CMV) permet de réduire la gravité et la fréquence des maladies à CMV dans les mois qui suivent la greffe.
En prophylaxie post-greffe d’organe, le valganciclovir est recommandé chez les patients CMV séronégatifs qui reçoivent un greffon provenant d’un donneur séropositif, car il y a un risque de primo-infection. Le létermovir est prescrit pour prévenir la réactivation du CMV après allogreffe de CSH.
Le traitement préemptif est associé à la mesure régulière de la charge virale pendant plusieurs mois après la greffe. Si la charge virale franchit un certain seuil, un traitement antiviral sera instauré. Le traitement de première intention est le ganciclovir. Les IgG spécifiques du CMV sont recherchées avant toute greffe chez le donneur et le receveur.
PROPHYLAXIE CHEZ LA FEMME ENCEINTE
La recherche des IgG anti-CMV de manière systématique n’est actuellement pas recommandée chez la femme enceinte en France.
| Points clés Il n’y a pas de vaccination disponible contre le CMV. Une sérologie systématique chez la femme enceinte n’est pas recommandée actuellement. Le statut vis-à-vis du CMV des patients en attente de greffe et des greffons est, en revanche, toujours recherché. Des traitements prophylactiques sont possibles en fonction de la greffe et du risque pour le patient. Le valganciclovir et le létermovir sont respectivement utilisés en prévention des infections lors des greffes d’organe ou de CSH. |
