Legionella pneumophila est une bactérie de l’environnement responsable d’une pneumopathie, la légionellose.
CARACTÉRISTIQUES BACTÉRIOLOGIQUES
TAXONOMIE
Famille : Legionellaceae, Genre : Legionella.
MORPHOLOGIE, CARACTÈRES CULTURAUX ET D’IDENTIFICATION
Bacille à Gram négatif aérobie strict, asporulé, mobile par un flagelle terminal en phase infectieuse (virulente).
Morphologie variable (bacilles plus ou moins longs selon la phase réplicative).
Culture sur milieux sélectifs, impliquant une demande spécifique par le prescripteur en raison des exigences culturales particulières de la bactérie (auxotrophie pour la L-cystéine). Absence de culture sur gélose au sang.
Milieux contenant de la L-cystéine et du charbon (BCYE [Buffered Charcoal Yeast Extract] ± antibiotiques et antifongiques [MWY — Modified Wadowsky Yee Agar, BMPA — Buffered céfaMandole Polymyxine Anisomycine α-cétoglutarate, GVPC] — glycine vancomycine polymyxine cycloheximide), incubés sous air ambiant ou sous 2,5 % de CO2.
Croissance lente (3 à 10 j) et difficile.
Aspect caractéristique des colonies « en verre fritté », avec reflets rosés/verts (figure II.7.1).
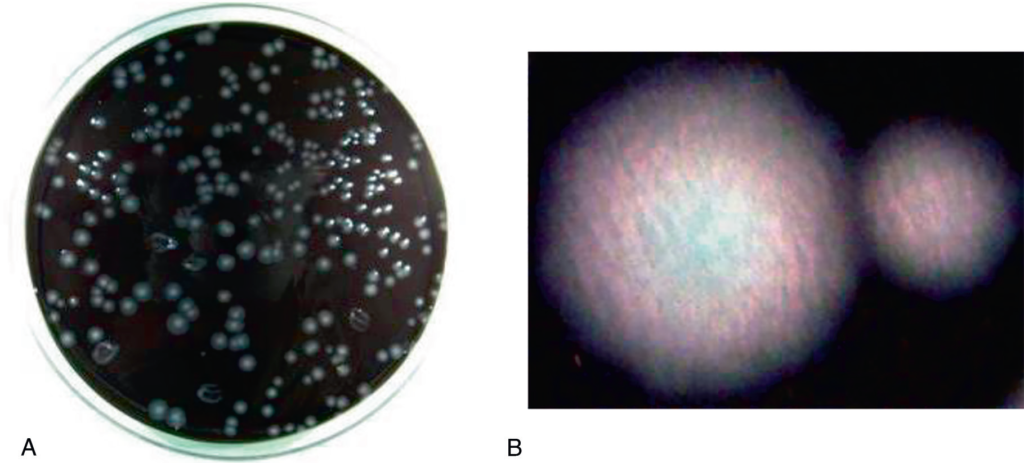
FACTEURS DE VIRULENCE
▶ Système de sécrétion de type I.
▶ Flagelline.
▶ Lipopolysaccharide (LPS), en particulier LPS du sérogroupe 1 (L. pneumophila sérogroupe 1 (Lp1) est responsable de 90 % des infections parmi les 15 sérogroupes décrits pour cette espèce).
| Points clés Le sérogroupe 1 de L. pneumophila est particulièrement impliqué en pathologie humaine. |
DONNÉES ÉPIDÉMIOLOGIQUES
Environ 1 500 cas/an de légionelloses en France avec un pic estival.
Létalité : 10 % (majorée en cas de retard au diagnostic).
Maladie à déclaration obligatoire. La connaissance du cas déclaré permet aux autorités de santé d’identifier la source afin d’éviter les épidémies (recherche des expositions à risque dans les 10 jours précédant les symptômes [hôtel, camping, maison de retraite, hôpital, station thermale, piscine, jacuzzi…]).
PHYSIOPATHOLOGIE ET MANIFESTATIONS CLINIQUES
HABITAT
Habitat naturel hydro-tellurique : eaux environnementales (lacs, rivières…) et sols humides, où la bactérie est présente à de faibles concentrations.
Colonisation des réseaux anthropisés/eaux artificielles (réseaux d’eau sanitaire chaude et froide, piscines, jacuzzis, fontaines, tours aéro-réfrigérantes…) où Legionella prolifère particulièrement à des températures comprises entre 25 et 45 °C.
Bactérie intracellulaire facultative, hôtes naturels environnementaux : amibes et ciliés.
PHYSIOPATHOLOGIE
PNEUMOPATHIE AIGUË
Appelée légionellose ou maladie des légionnaires.
Inhalation d’aérosols contaminés par la bactérie qui infecte les monocytes-macrophages et les cellules épithéliales pulmonaires. Après internalisation dans la cellule hôte, la bactérie forme une vacuole à partir du réticulum endoplasmique (Legionella Containing Vacuole, LCV), s’y multiplie et empêche la fusion endosome-lysosome.
Période d’incubation : 2 à 10 jours.
Pas de transmission inter-humaine.
AUTRES MANIFESTATIONS CLINIQUES
▶ La fièvre de Pontiac (syndrome pseudo-grippal) est une forme clinique rarement diagnostiquée, jamais mortelle, dont la physiopathologie n’est pas élucidée. L’inhalation de LPS bactérien est une hypothèse.
Les formes extrapulmonaires sont soit secondaires à une pneumopathie, soit primitives (inoculation directe au site de l’infection).
PRINCIPALES MANIFESTATIONS CLINIQUES
Pneumopathie aiguë communautaire (> 90 % cas) ou nosocomiale du sujet adulte, d’allure progressive, sans spécificité clinique, et associée à une toux initialement non productive. Images radiologiques non pathognomoniques, uni/plurilobaires, uni/bilatérales.
Manifestations fréquemment associées : digestives (douleurs abdominales, diarrhées, vomissements) et neurologiques (troubles de la conscience, confusion, céphalées).
FACTEURS DE RISQUE
Sexe masculin, âge avancé, tabagisme, maladie respiratoire chronique, diabète, maladie immunitaire, traitement immunosuppresseur, corticothérapie, cancer. 3/4 des patients présentent au moins 1 facteur de risque.
Elle doit être évoquée devant toute pneumopathie associée à des troubles digestifs et/ou neurologiques, en particulier en cas d’échec de traitement par bêta-lactamines.
| Points clés L. pneumophila est une bactérie hydro-tellurique intracellulaire, pathogène strict. L’Homme est un hôte accidentel. La légionellose est une pneumopathie de sévérité variable, mortelle dans 10 % des cas. |
DIAGNOSTIC
DIAGNOSTIC DIRECT
a) Examen direct
Non réalisé pour le diagnostic.
b) Détection des antigènes urinaires
Excrétion urinaire d’antigènes de L. pneumophila 2 à 3 jours après le début des symptômes, prolongée jusqu’à plusieurs mois après la guérison.
Technique limitée à la détection du LPS de L. pneumophila de sérogroupe 1 (les autres sérogroupes sont très rarement détectés).
Tests immunochromatographiques (avec détection par colorimétrie ou immunofluorescence) permettant l’obtention de résultats en moins d’une heure.
Sensibilité et spécificité variables en fonction des tests (respectivement 85–95 % pour Lp1 et > 99 % pour les plus performants).
c) PCR spécifique
Technique complémentaire à la détection des antigènes urinaires, réalisée sur un prélèvement bronchopulmonaire profond, et permettant la détection de toutes les espèces et sérogroupes de Legionella.
PCR « maison » ou trousses commerciales de PCR en temps réel (la cible L. pneumophila est intégrée aux panels syndromiques).
Sensibilité : 80 à 100 % sur prélèvements respiratoires profonds, excellente spécificité.
Résultats en quelques heures.
d) Culture
Réalisée en général en 2e intention en cas d’antigénurie ou de PCR positive.
Culture sur milieux sélectifs, impliquant une demande spécifique par le prescripteur.
Milieux contenant de la L-cystéine et du charbon (BCYE [Buffered Charcoal Yeast Extract]) ± antibiotiques et antifongiques (MWY, BMPA, GVPC), incubés sous air ambiant ou sous 2,5 % de CO2.
Croissance lente (3 à 10 jours).
Identification de l’espèce L. pneumophila par MALDI-TOF (Matrix Assisted Laser Desorption Ionisation/Time of Flight), et du sérogroupe par latex-agglutination (réactifs Lp1 ou Lp2-14) ou immunofluorescence (technique limitée aux centres nationaux de référence, CNR).
La culture permet le typage des souches isolées et la réalisation d’enquêtes épidémiologiques. Une souche est isolée en France dans 25 % des cas de légionellose. Le typage des souches de L. pneumophila est réalisé par séquençage du génome (Whole Genome Sequencing, WGS).
e) Anomalies non spécifiques du bilan biologique
Sont classiquement associées à la légionellose : hyponatrémie, hypophosphorémie, cytolyse hépatique, rhabdomyolyse (CPK [créatines phosphokinases] élevées), insuffisance rénale, CRP (C-Reactive Protein) élevée.
DIAGNOSTIC INDIRECT
La sérologie (technique ELISA) est idéalement faite à J0 (début des signes) et après J15, mais la séroconversion est inconstante.
Cette technique n’est pas recommandée en 1re intention. Elle ne permet qu’un diagnostic rétrospectif et est utile lorsque les techniques de diagnostic direct n’ont pas été réalisées à temps. Elle est peu pratiquée. Elle manque de sensibilité et de spécificité. Les anticorps confèrent une immunité non protectrice : un patient peut faire plusieurs légionelloses dans sa vie.
| Points clés Le diagnostic de 1re intention repose sur la détection des antigènes urinaires de L. pneumophila de sérogroupe 1. La PCR sur prélèvement bronchopulmonaire vient compléter les outils diagnostiques et doit être réalisée en cas de forte suspicion, lorsque l’antigénurie est négative. La sérologie est à limiter aux rares cas pour lesquels le diagnostic de légionellose n’a pas été évoqué initialement. La culture a un intérêt épidémiologique, elle permet les enquêtes autour d’un cas. |
SENSIBILITÉ AUX ANTIBIOTIQUES ET TRAITEMENT
L. pneumophila est naturellement résistante aux bêta-lactamines, par sécrétion d’une bêta-lactamase et par sa localisation intracellulaire.
Le traitement repose sur l’utilisation de trois familles d’antibiotiques : macrolides, fluoroquinolones et rifampicine. Les antibiogrammes ne sont pas réalisés en raison de l’absence de résistance acquise.
La stratégie thérapeutique diffère en fonction du type de patient et de la sévérité de la légionellose (Afssaps, juin 2011) (tableau II.7.1).
Tableau II.7.1 Stratégie thérapeutique du traitement antibiotique des légionelloses selon la gravité.
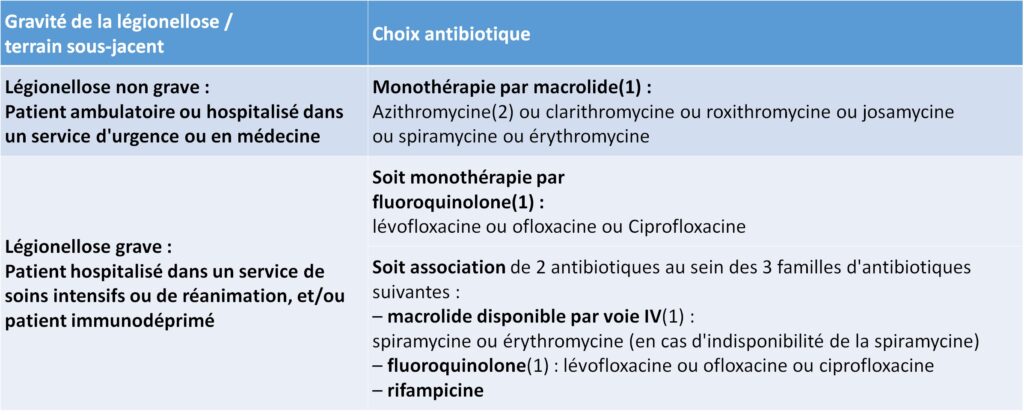
(2) L’azithromycine est recommandée de par son efficacité démontrée dans les legionelloses même si cette molécule n’a pas l’AMM dans cette indication.
| Points clés Les macrolides, les fluoroquinolones et la rifampicine sont les antibiotiques de choix pour le traitement de la légionellose. Ils sont utilisés en mono ou bithérapie en fonction du patient et de la sévérité du tableau clinique. Les antibiogrammes ne sont pas réalisés. Il n’existe pas de résistance acquise aux antibiotiques. |
PRÉVENTION
AU DOMICILE
Les enquêtes autour d’un cas de légionellose identifient une contamination au domicile du patient dans 40 % des cas.
Détartrage annuel des robinets, flexibles et pommeaux de douches. Entretien annuel des chauffe-eaux avec maintien d’une température > 60 °C.
DANS LES ÉTABLISSEMENTS DE SANTÉ ET LES ÉTABLISSEMENTS RECEVANT DU PUBLIC
Obligation réglementaire de maintenance et contrôle régulier des réseaux d’eau :
▶ connaissance des plans du réseau d’eau, identification des points d’eau défavorisés et suppression des boucles et bras morts ;
▶ détartrage ;
▶ température suffisante : 60 °C à la production, 50 °C aux points d’usage ;
▶ taux de chlore suffisant : 1 mg/L ;
▶ contrôles bactériologiques au moins annuels des points d’eau défavorisés (filtration de l’échantillon d’eau et mise en culture du filtre sur milieu sélectif) : résultat conforme < 1 000 UFC/L dans tous les services sauf ceux hébergeant des patients à haut risque (immunodépression sévère, corticothérapie prolongée ou à haute dose) où le seuil doit être < 10 UFC/L.
Tours aéro-réfrigérantes (TAR) : nettoyage et contrôles réguliers, seuils réglementaires.
Disposer de conduite à tenir en cas de dépassement du seuil réglementaire : choc chloré, choc thermique ou chloration continue.
Conduite à tenir en cas de cas nosocomial :
▶ recherche de la source de contamination : campagnes de prélèvements sur les points d’eau utilisés par le patient ;
▶ évaluation de l’étendue de la contamination par des campagnes de prélèvements sur les points d’eau alimentés par le même réseau d’eau ;
▶ interdiction de l’usage de tous les points d’eau du service jusqu’au retour à la normale ;
▶ surveillance des patients hospitalisés et ayant été exposés au même risque ;
▶ filtration terminale des points d’usage (service accueillant des patients immunodéprimés).
DÉCLARATION OBLIGATOIRE
Cette double déclaration (par le clinicien et le biologiste) à l’ARS (agence régionale de santé) permet la réalisation de l’enquête autour d’un cas et la détection de cas groupés et d’épidémies. Elle permet de réaliser les investigations et de mettre en place des actions correctrices curatives et préventives.
Les enquêtes autour des cas de légionellose (interrogatoires portant sur les expositions pendant la période d’incubation) permettent d’identifier les sources de contamination potentielles.
| Points clés L’entretien et la surveillance des réseaux d’eau est le point clé pour la prévention des légionelloses. Les investigations montrent que les domiciles sont les lieux majeurs de contamination, mais la surveillance du risque de légionelle lié à l’eau des domiciles n’est pas réglementée. La déclaration obligatoire permet de détecter et limiter les épidémies. |
