Afin d’aider le clinicien à prendre en charge une infection bactérienne, en particulier lorsqu’elle est sévère et/ou qu’elle a nécessité la réalisation d’un prélèvement microbiologique, le laboratoire va tester la sensibilité de la(les) bactérie(s) responsable( s) de l’infection à un certain nombre d’antibiotiques. L’objectif de ce test appelé antibiogramme est de savoir si la bactérie identifiée a acquis un ou plusieurs mécanismes de résistance pour pouvoir adapter le traitement antibiotique afin d’obtenir la meilleure efficacité possible en limitant au maximum l’impact de cet antibiotique sur le microbiote du patient. La réalisation de ce test est soumise au respect d’un nombre important de paramètres afin que cette analyse soit standardisée pour des résultats reproductibles et comparables.
Le choix des antibiotiques testés dépend de la bactérie en cause ; il faut au minimum une orientation vers un groupe de bactéries, Enterobacterales, staphylocoques, streptocoques… Le choix de l’antibiotique utilisé au final dépendra des résistances observées, de la diffusion sur le site de l’infection et tiendra compte d’éventuelles contre-indications ou interactions médicamenteuses.
L’objectif de l’antibiogramme est de catégoriser cliniquement la sensibilité des bactéries aux antibiotiques afin de prédire une efficacité chez le malade.
L’ancienne catégorisation clinique (S pour sensible, I pour intermédiaire et R pour résistant) a été redéfinie par l’EUCAST (European Committee on Antimicrobial Susceptibility Testing – organisme européen d’uniformisation des pratiques de l’antibiogramme) en 2018 en lien avec les comités nationaux européens (comité de l’antibiogramme de la société française de microbiologie ou CA-SFM pour la France). Cette catégorisation clinique est directement reliée au niveau d’exposition de la bactérie à l’antibiotique sur le site infectieux. Cette exposition dépend du mode d’administration, de la posologie, des intervalles entre plusieurs administrations, mais aussi des caractéristiques pharmacocinétiques de l’antibiotique.
La catégorisation clinique intermédiaire disparaît. Les lettres S, SFP et R prennent désormais les significations suivantes :
▶ S pour « sensible à posologie standard » ou plus simplement sensible. Une bactérie est catégorisée sensible à posologie standard lorsqu’il y a une probabilité élevée de succès thérapeutique à posologie standard de l’antibiotique ;
▶ SFP pour « sensible à forte posologie ». Une bactérie sera catégorisée sensible à forte posologie lorsqu’il y a une forte probabilité de succès thérapeutique due au fait que l’exposition de la bactérie à l’antibiotique est augmentée par l’utilisation de posologies élevées ou si l’antibiotique est fortement concentré au site de l’infection ;
▶ R pour « résistant ». Une bactérie est catégorisée résistante lorsqu’il y a une forte probabilité d’échec thérapeutique même en cas de forte exposition de la bactérie à l’antibiotique.
La zone d’incertitude thérapeutique (ZIT) correspond à une zone d’incertitude portant sur la catégorisation clinique en particulier lorsque :
▶ lorsque la valeur critique coupe la distribution de la population sauvage.
▶ les distributions de la population sauvage et de la population résistante sont contiguës, voire partiellement superposées ;
▶ lorsque la valeur critique coupe la population résistante ;
GÉNÉRALITÉS – NOTION DE BACTÉRIOSTASE ET DE BACTÉRICIDIE
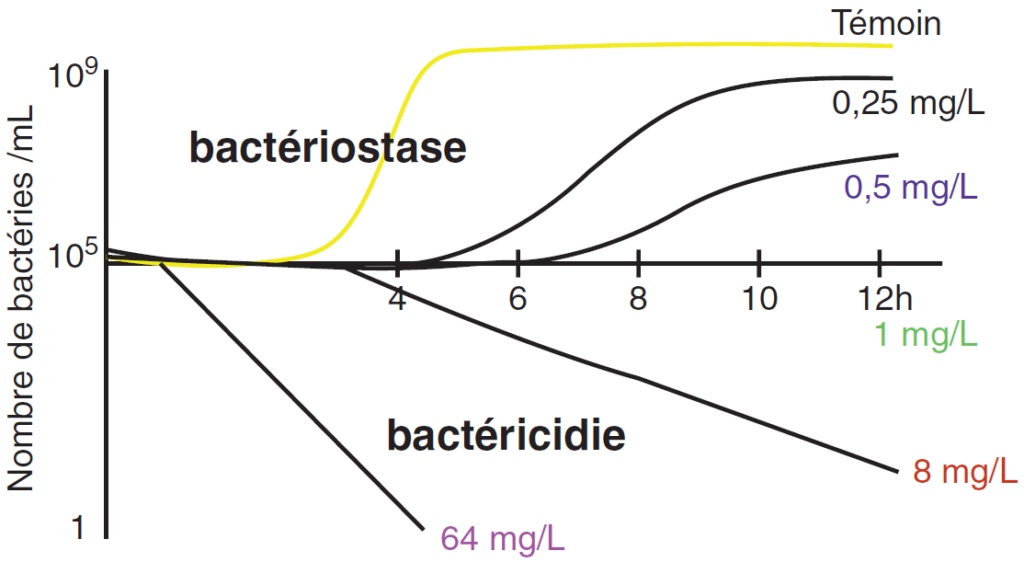
L’interaction d’une bactérie et d’un antibiotique selon le temps d’exposition et la concentration de l’antibiotique se traduit soit par une inhibition ou un ralentissement de la croissance (bactériostase), soit par une destruction de la bactérie (bactéricidie) (figure IV.1.1).
La concentration minimale inhibitrice ou CMI définie en milieu liquide, qui explore la bactériostase, correspond à la plus faible concentration d’antibiotique (habituellement exprimée en mg/L) inhibant toute croissance bactérienne visible macroscopiquement, les conditions de culture étant standardisées (figure IV.1.2). Cette CMI peut également être déterminée en milieu solide.
La concentration minimale bactéricide (CMB) explore la bactéricidie et est définie par la plus faible concentration d’antibiotique pour laquelle le nombre de colonies bactériennes, obtenues par repiquage sur milieu solide des tubes sans crois sance visible lors de la détermination de la CMI, est inférieur à 99,99 % de l’inoculum de départ. La CMB n’est pas utilisée au quotidien.

ANTIBIOGRAMME ET DÉTERMINATION DE LA CONCENTRATION MINIMALE INHIBITRICE
En pratique courante, c’est la détermination de la concentration minimale inhibitrice (CMI) qui est utilisée pour catégoriser cliniquement les souches en S, SFP ou R.
La sensibilité des bactéries aux antibiotiques peut être déterminée par différentes méthodes, en milieu liquide ou en milieu gélosé ; techniques manuelles ou semi-automatisées. Les tests peuvent ne concerner qu’un seul antibiotique, c’est le cas le plus souvent pour les déterminations des CMI « vraies », ou bien une large gamme de molécules et dans ce cas, ce sont souvent des CMI « approchées » qui sont utilisées pour déterminer la catégorisation clinique de chaque molécule.
Quelle que soit la méthode, la CMI obtenue est confrontée aux concentrations critiques (inférieure « c » et supérieure « C » en mg/L) définies par l’EUCAST et le CA-SFM. Ces concentrations critiques sont établies suivant des paramètres pharmacocinétiques et pharmacodynamiques, du profil habituel de sensibilité à l’antibiotique au sein de l’espèce, du taux de résistance acquise et éventuellement de données issues de l’expérience clinique.
DÉTERMINATION DE CMI « VRAIE »
La méthode de détermination de la CMI « vraie » est effectuée par microdilution en milieu liquide (barrettes unitaires permettant de tester un seul antibiotique) ou en microplaques, ainsi que par la technique des bandelettes de type E-test® ou MICE-test® (chaque bandelette permet de tester un seul antibiotique).
DÉTERMINATION DE LA CMI PAR MICRODILUTION EN MILIEU LIQUIDE
Pour les tests commercialisés, la technique est basée sur la réhydratation des antibiotiques contenus dans des barrettes unitaires ou des microplaques, par l’ajout d’une suspension standardisée de bactéries (mesurée en McFarland, dépendant du type de bactérie) (figure IV.1.3). Il est important d’utiliser un bouillon de Mueller-Hinton (MH) qui peut être ajusté en ions pour certains antibiotiques. Après 18–24 heures d’incubation en général à 35 ± 2 °C, le résultat est lu visuellement et interprété. C’est la seule méthode validée actuellement pour certains antibiotiques (ex. colistine pour les bacilles à Gram négatif ou les glycopeptides pour les staphylocoques).

DÉTERMINATION DE LA CMI PAR GRADIENT EN GÉLOSE (DE TYPE E-TEST®)
C’est une technique de diffusion en milieu gélosé (Mueller-Hinton). Elle repose sur l’utilisation de bandelettes qui présentent des quantités croissantes de l’antibiotique étudié. Il s’agit d’une mince bandelette de plastique inerte et non poreuse calibrée avec une échelle de CMI exprimée en mg/L, qui comporte sur la partie haute le sigle permettant d’identifier l’agent antimicrobien. Un gradient prédéfini de concentrations d’antibiotique comprenant en général une quinzaine de dilutions est immobilisé sur l’autre surface du support.
Lorsqu’une bandelette de type E-test® est appliquée sur la surface d’une gélose préalablement ensemencée à l’écouvillon avec une suspension standardisée de bactéries, le gradient exponentiel préformé de l’agent antimicrobien est immédiatement transféré dans la gélose. Le gradient de concentration, continu et prédéfini, établi le long de la bandelette reste stable pendant une longue période.
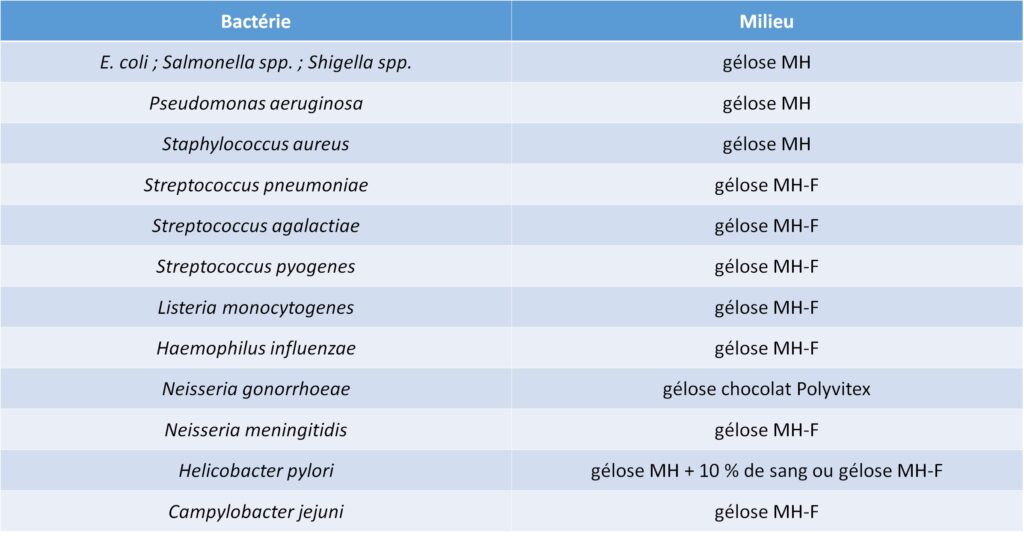
Le choix de la gélose dépend de la bactérie (tableau IV.1.1). Il s’agit des géloses Mueller-Hinton (MH) ou MH-F pour les bactéries exigeantes (Mueller-Hinton fastidious agar, soit MH enrichi avec 5 % de sang de cheval et 20 mg/L de bêta-NAD). Après la période d’incubation, habituellement de 16 à 24 h à 35 ± 2 °C, une ellipse d’inhibition symétrique centrée le long de la bandelette est formée. La CMI est lue directement à partir de l’échelle de graduation et exprimée en mg/L au point où l’ellipse d’inhibition croise la bandelette (figure IV.1.4).
Tableau IV.1.1 Milieux utilisés pour la réalisation des antibiogrammes en milieu gélosé selon la bactérie.

DÉTERMINATION DE CMI PAR MÉTHODE AUTOMATISÉE
Afin de pouvoir tester un plus grand nombre d’antibiotiques simultanément, une détermination de CMI vraie ou « approchée » selon l’automate et la gamme d’antibiotique testée permet la catégorisation clinique de chaque molécule.
Les méthodes d’antibiogramme semi-automatisées sont soit en milieu liquide, on peut citer Vitek® (bioMérieux), Phoenix ® (BD), WalkAway® (Siemens) ; soit par diffusion en milieu gélosé dont l’incubation et la lecture peut être automatisée (SIRScan [i2A]). Ces systèmes sont associés à des logiciels d’expertise des résultats intégrés.
En pratique, les laboratoires réalisent la plupart des antibiogrammes soit par des méthodes semi-automatisées, soit par la méthode de diffusion en gélose, cette dernière permettant aussi de contrôler des résultats inhabituels obtenus par la méthode semi-automatisée.
L’ANTIBIOGRAMME PAR MÉTHODE SEMIAUTOMATISÉE EN MILIEU LIQUIDE
Le principe repose sur une lecture spectrophotométrique ou turbidimétrique de micropuits contenant des concentrations déterminées d’antibiotiques pour encadrer les concentrations critiques. C’est une estimation de la CMI. Cette méthode est surtout applicable aux espèces à croissance rapide. Le bouillon utilisé est un bouillon MH. Le choix des molécules est dépendant du fabricant.
L’ANTIBIOGRAMME PAR DIFFUSION EN MILIEU GÉLOSÉ
La surveillance d’un nombre plus grand de paramètres est nécessaire pour garantir à l’antibiogramme ses performances.
▶ Les disques d’antibiotiques (diamètre de 6 mm, charge du disque en antibiotique définie par l’EUCAST et le CA-SFM, conditions de conservation).
▶ Le milieu utilisé : Mueller-Hinton (MH) à pH précis (7,2 à 7,4) avec des concentrations ioniques définies, MH-F (MH additionné de 5 % de sang frais pour la plupart des bactéries exigeantes) (tableau IV.1.1)…
▶ L’épaisseur de la gélose : 4 mm.
▶ Les modalités de conservation des réactifs (dates de péremption).
▶ L’inoculum bactérien (l’idéal est d’obtenir des colonies juste confluentes). Un mode d’ensemencement trop riche diminue les zones d’inhibition et inversement. Pour la plupart des bactéries non exigeantes (Enterobacterales, Pseudomonas aeruginosa, staphylocoques…), l’inoculum préparé est ajusté à 0,5 McFarland (soit environ 1 × 108 bactéries/mL pour E. coli).
▶ Les modalités d’ensemencement : l’écouvillonnage est privilégié.
▶ Les conditions d’incubation (aérobiose, microaérophilie, 5 % de CO2, anaérobiose) dépendant en partie des exigences de croissance des bactéries.
▶ Le délai d’incubation en général de 16 à 24 heures, éventuellement prolongé selon le pathogène ou l’antibiotique.
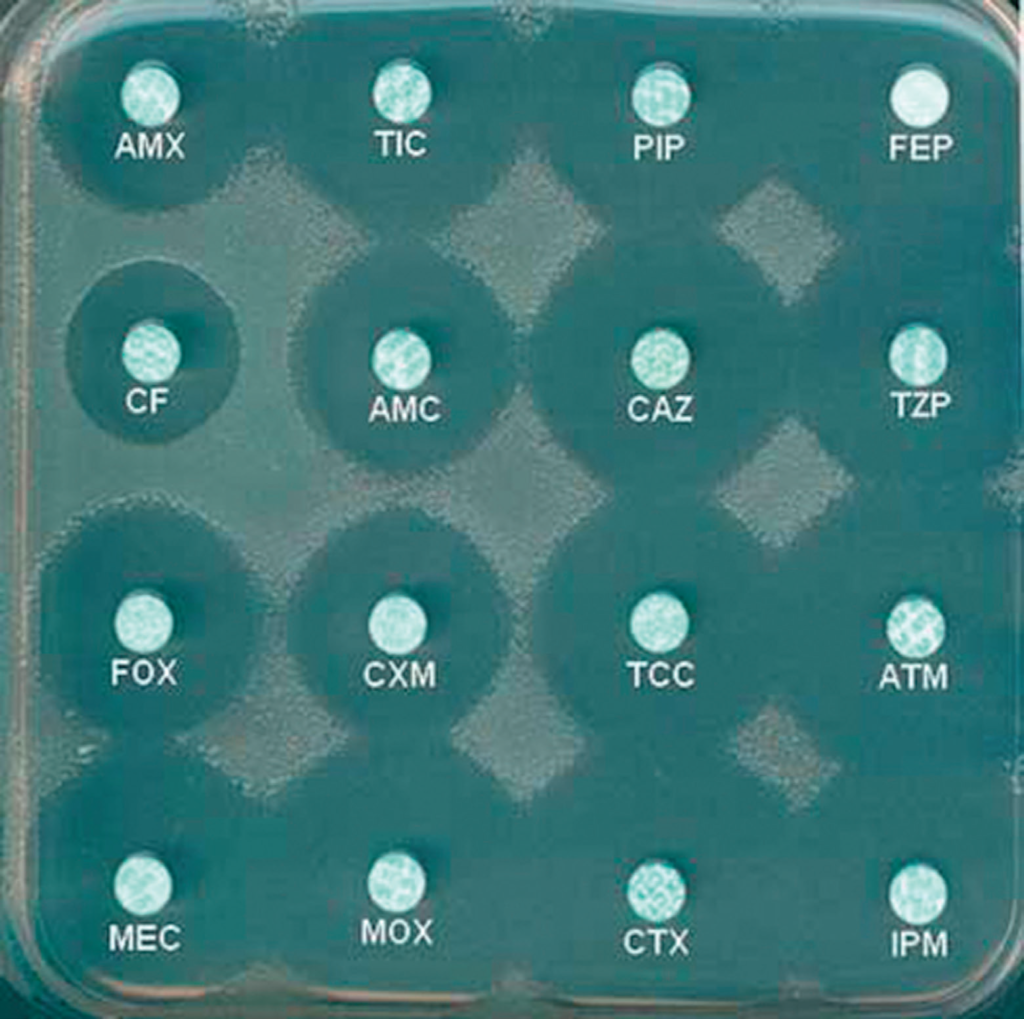
La suspension bactérienne standardisée de la souche à étudier (0,5 McFarland) est ensemencée à l’écouvillon sur une gélose (MH, MH-F ou chocolat selon les exigences nutritives de la bactérie). Après incubation pendant une période adaptée à 35 ± 2 °C, une zone d’inhibition de croissance peut être observée autour du disque. La lecture et l’interprétation se font selon les recommandations du CA-SFM qui émettent des diamètres critiques (D et d en mm).
Un exemple de résultat d’antibiogramme par diffusion en milieu gélosé est représenté figure IV.1.5.
De plus, l’antibiogramme par diffusion permet d’observer des images précisant les interactions entre plusieurs antibiotiques. Un phénomène de synergie (figure IV.1.6) lié à certains mécanismes de résistance comme la synthèse de bêta-lactamase à spectre étendu (BLSE) peut être détecté. Des antagonismes peuvent également être observés.