Streptococcus pneumoniae, le pneumocoque, est un pathogène majeur responsable en particulier d’infections ORL et pulmonaires, mais également d’infections invasives.
Streptococcus pneumoniae, le pneumocoque, est un pathogène majeur responsable en particulier d’infections ORL et pulmonaires, mais également d’infections invasives.
CARACTÉRISTIQUES BACTÉRIOLOGIQUES
TAXONOMIE
Embranchement des Firmicutes, famille des Streptococcaceae, genre Streptococcus.
MORPHOLOGIE, CARACTÈRES CULTURAUX ET D’IDENTIFICATION
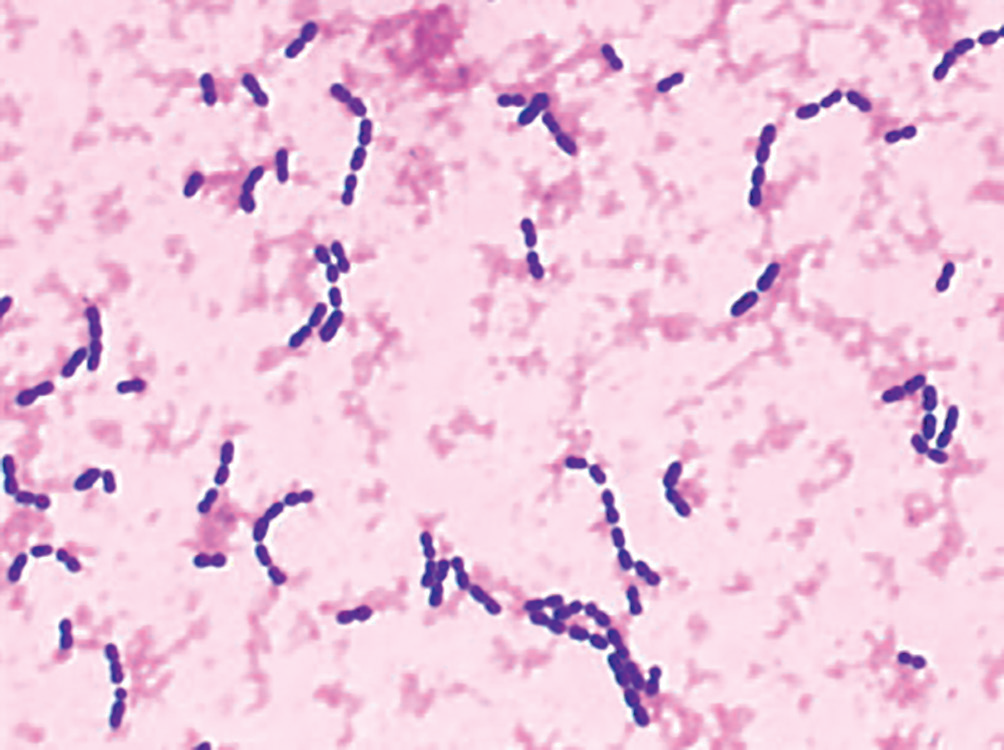
Cocci à Gram positif, immobiles et asporulés, généralement sous forme de diplocoques lancéolés appariés par leurs extrémités (figure II.17.1). À quelques rares exceptions, les isolats cliniques sont capsulés. Toutes les souches possèdent un antigène pariétal polyosidique (polyoside C), correspondant aux acides teichoïques.
Bactérie exigeante, se développant sur gélose au sang en donnant une hémolyse partielle (alpha-hémolyse) sur sang frais. Type respiratoire anaérobie aéro-tolérant. Seul streptocoque sensible à l’optochine (éthyl-hydrocupréine).
FACTEURS DE VIRULENCE
Les deux facteurs de virulence majeurs du pneumocoque sont la capsule, structure antiphagocytaire de nature polysaccharidique, permettant de définir plus de 90 sérotypes différents, et la pneumolysine, toxine membranolytique libérée lors de la lyse bactérienne.
DONNÉES ÉPIDÉMIOLOGIQUES
C’est une bactérie responsable d’infections communautaires. Les infections ORL et pulmonaires sont majoritaires.
En France, il est estimé annuellement presque 700 méningites et 5 800 bactériémies isolées à pneumocoque (Santé publique France, données 2019).
L’incidence est élevée chez le jeune enfant et augmente chez le sujet âgé.
PHYSIOPATHOLOGIE ET MANIFESTATIONS CLINIQUES
HABITAT
S. pneumoniae est un pathogène strictement humain. Son réservoir est le rhinopharynx. Le portage chez l’enfant en crèche est de l’ordre de 50 à 60 % et chez l’adulte de 10 à 20 %.
PHYSIOPATHOLOGIE
La transmission est interhumaine, non épidémique.
Le pneumocoque est une bactérie à multiplication extracellulaire, dont la physiopathologie est liée en partie à la libération lors de la lyse bactérienne de composants fortement pro-inflammatoires.
a) Otite moyenne aiguë purulente (OMA) : généralement secondaire à une infection virale de la sphère oropharyngée ; l’inflammation de la trompe d’Eustache entraîne une diminution du drainage du mucus, et la prolifération dans l’oreille moyenne des pneumocoques provenant du rhinopharynx.
b) Pneumonie : dissémination d’une souche à partir du rhinopharynx.
c) Méningite : l’invasion des méninges se fait essentiellement par voie hématogène ; elle entraîne une forte réaction inflammatoire et la rupture de l’intégrité de la barrière hémato- encéphalique, à l’origine d’un oedème cérébral et d’une augmentation de la pression intracrânienne. Une méningite par contiguïté d’une infection ORL est possible mais est plus rare.
PRINCIPALES MANIFESTATIONS CLINIQUES
Classiquement, on distingue :
▶ les infections non invasives où le pneumocoque va exercer son pouvoir pathogène au niveau des muqueuses par extension à partir de son réservoir rhinopharyngé
▶ les infections invasives surviennent après la phase d’invasion qui a généralement lieu au niveau de la muqueuse pharyngée ou au niveau des alvéoles pulmonaires.
INFECTIONS ORL
▶ OMA purulente ; symptômes généraux d’infection aiguë et signes fonctionnel (otalgie ++) ; une fièvre élevée et une symptomatologie hyperalgique oriente le diagnostic étiologique vers S. pneumoniae.
▶ Sinusites : S. pneumoniae est une étiologie majeure de sinusite purulente quelle que soit sa localisation.
INFECTIONS PULMONAIRES
▶ S. pneumoniae est l’agent étiologique principal des pneumonies aiguës communautaires (PAC) et réalise une pneumonie franche lobaire aiguë (PFLA), dont la présentation clinique typique associe un début brutal, une fièvre élevée et un malaise général. Les PFLA sont bactériémiques dans ≈ 20 % des cas. Chez l’enfant, la PAC à pneumocoque s’observe essentiellement avant 5 ans.
▶ Exacerbations de bronchopneumopathies chroniques obstructives (BPCO) : fréquentes.
INFECTIONS INVASIVES À PNEUMOCOQUE
▶ Bactériémies : souvent secondaires à une pneumonie chez l’adulte, peuvent être occultes chez le jeune enfant.
▶ Méningites : S. pneumoniae en est l’agent étiologique majeur en France ; mortalité ≈ 20 % et séquelles (essentiellement auditives et neurologiques) fréquentes ; symptomatologie clinique = syndrome méningé classique, mais chez le nourrisson, signes cliniques souvent frustes et peu spécifiques.
▶ Autres localisations : foyers secondaires aux bactériémies, rares (arthrites, endocardites, pleurésies…).
FACTEURS DE RISQUE
Les enfants âgés de moins de 2 ans, les sujets âgés, les patients immunodéprimés (quelle que soit l’origine de l’immunodépression) ainsi que les patients porteurs de pathologies sousjacentes (insuffisances organiques, hépatopathie chronique, diabète, asthme sévère, brèche ostéoméningée, implant cochléaire) sont plus à risque de développer une infection invasive à pneumocoque (IIP).
| Points clés Le pneumocoque est un pathogène majeur responsable surtout d’infections ORL et pulmonaires. Il est également responsable de bactériémies et de méningites (1re cause de méningite bactérienne communautaire). |
DIAGNOSTIC
DIAGNOSTIC DIRECT
Les prélèvements sont liés à la présentation clinique : expectorations, aspirations bronchiques ou autre prélèvement d’origine respiratoire dans les infections pulmonaires ; pus d’oreille moyenne dans les OMA, prélèvement sinusien dans les sinusites ; LCR dans les méningites et hémocultures systématiquement réalisées dans les infections invasives.
EXAMEN DIRECT
La sensibilité de l’examen direct après coloration de Gram varie en fonction des produits pathologiques observés. Cet examen est particulièrement contributif au cours de l’analyse d’un LCR.
CULTURE ET IDENTIFICATION
Bactérie fragile, les échantillons biologiques doivent être acheminés et pris en charge rapidement. La culture d’un pneumocoque se fait sur gélose enrichie, de préférence en atmosphère à 5 % de CO2. L’identification de colonies de pneumocoque se fait sur plusieurs critères :
▶ hémolyse partielle alpha sur gélose au sang frais (Streptocoque α-hémolytique) (figure II.17.2) ;
▶ catalase négative ;
▶ sensibilité à l’optochine (≈ 95 % des souches) (figure II.17.2).
Identification par spectrométrie de masse de type MALDI-TOF (Matrix Assisted Laser Desorption Ionisation/Time of Flight), même si parfois la discrimination peut être difficile avec des streptocoques oraux.

AUTRES MÉTHODES DE DÉTECTION
▶ Détection de l’antigène soluble des pneumocoques (polyoside C) par test immunochromatographique sur membrane, validé pour la détection dans les urines (pneumonies) et le LCR (méningites) ; ce test présente une bonne sensibilité et une spécificité acceptable (mais réactions croisées possibles avec autres bactéries).
▶ Recherche d’ADN génomique par PCR dans certains prélèvements en cas de culture négative (LCR ++).
▶ Approche syndromique (PCR multiplex) : des amorces spécifiques du pneumocoque sont incluses dans la majorité des kits diagnostiques pour les syndromes méningés et les syndromes respiratoires.
DIAGNOSTIC INDIRECT
Pas de diagnostic sérologique.
| Points clés Le diagnostic d’infection à pneumocoque repose sur la culture, en particulier les hémocultures dans les infections invasives. La recherche des antigènes solubles peut être utile, en particulier dans les pneumonies de l’adulte. Les techniques moléculaires viennent compléter les outils diagnostiques, en particulier dans les méningites. |
SENSIBILITÉ AUX ANTIBIOTIQUES ET ANTIBIOGRAMME
S. pneumoniae est naturellement sensible à de nombreux antibiotiques.
La résistance acquise aux bêta-lactamines est liée à la formation de PLP (protéines de liaison à la pénicilline) mosaïques à la suite d’échanges génétiques avec des streptocoques oraux. Les pneumocoques de sensibilité diminuée à la pénicilline (PSDP), présentent des niveaux de résistance différents selon les molécules mais l’amoxicilline, le céfotaxime et la ceftriaxone restent les plus actifs. En 2019, environ 30 % des souches isolées d’IIP étaient des PSDP.
Un antibiogramme doit être réalisé de manière systématique en cas d’infection grave ou d’échec clinique. Devant tout PSDP (OXA-1 < 20 mm ou CMI de pénicilline G > 0,064 mg/L), il est recommandé de déterminer la CMI d’au moins une des bêta-lactamines suivante : amoxicilline, céfotaxime, ceftriaxone. Il existe des résistances acquises aux macrolides (environ 20– 30 %). Les glycopeptides conservent leur efficacité.
| Points clés L’antibiogramme et la détermination des CMI vis-à-vis des bêta-lactamines est indispensable dans les infections invasives à pneumocoques. |
TRAITEMENT
OTITE MOYENNE AIGUË (RECOMMANDATIONS SPILF, 2011)
Antibiothérapie recommandée chez les enfants < 2 ans, les adultes et les enfants > 2 ans avec une symptomatologie bruyante. Traitement de première intention : amoxicilline ; en cas d’allergie à l’amoxicilline : cefpodoxime-proxétil si allergie non croisée, ou cotrimoxazole dans le cas contraire.
PNEUMONIES AIGUËS COMMUNAUTAIRES (MISE AU POINT SPILF/AFSSAPS, 2010)
Traitement généralement probabiliste mais doit être actif sur S. pneumoniae du fait de la fréquence et de la gravité potentielle de l’infection pneumococcique. L’amoxicilline par voie orale est privilégiée (excellente diffusion dans le parenchyme pulmonaire qui permet d’être efficace, même en cas de PSDP). En cas d’allergie à l’amoxicilline, les macrolides peuvent être utilisés (si sensible). Avant 3 ans, les céphalosporines de 3e génération par voie injectable seront privilégiées (sauf allergie croisée).
MÉNINGITES (CONFÉRENCE DE CONSENSUS, 2017)
En cas d’examen direct positif évoquant un pneumocoque, ou en cas en cas d’examen direct négatif sans argument en faveur de listériose, le traitement probabiliste repose sur l’utilisation des céphalosporines de 3e génération par voie injectable (céfotaxime ou ceftriaxone), à doses élevées dites méningées. Après documentation, une désescalade thérapeutique est possible (amoxicilline IV), en cas de souche sensible. Une corticothérapie adjuvante (dexaméthasone) est recommandée si elle initiée précocement.
Le traitement doit être instauré le plus rapidement possible dès l’arrivée à l’hôpital.
BACTÉRIÉMIES
L’antibiothérapie repose sur l’utilisation d’amoxicilline par voie IV ou de céphalosporines de 3e génération par voie injectable.
| Points clés Les bêta-lactamines (amoxicilline, céfotaxime ou ceftriaxone) sont le traitement de première intention des infections à pneumocoque, malgré le développement de résistances acquises. |
PRÉVENTION
La prophylaxie des infections à pneumocoque repose essentiellement sur la vaccination. Quatre vaccins à base de polyosides capsulaires seront désormais disponibles en France. Ils confèrent une protection sérotype-dépendante.
▶ Un vaccin pneumococcique polyosidique 23-valent (VPP 23) (Pneumovax®) : constitué de polyosides capsulaires purifiés de 23 sérotypes, induit une réponse thymo-indépendante (non immunogène < 2 ans, sans immunité muqueuse et induisant peu d’immunité mémoire).
▶ Un vaccin pneumococcique conjugué 13-valent (VPC 13) (Prevenar 13®) : constitué de polyosides capsulaires purifiés de 13 sérotypes conjugués à une protéine porteuse, ce qui permet le développement d’une réponse immunitaire chez les enfants à partir de 2 mois. Ce vaccin induit une immunité muqueuse, il modifie le portage et entraîne une immunité de groupe vis-à-vis des sérotypes vaccinaux.
▶ Depuis mai 2024, un vaccin pneumococcique conjugué 15-valent (VPC 15) (Vaxneuvance®) : constitué de polyosides capsulaires purifiés de 15 sérotypes.
▶ Depuis mai 2024, un vaccin pneumococcique conjugué 20-valent (VPC 20) (Prevenar 20®) : constitué de polyosides capsulaires purifiés de 20 sérotypes.
▶ Recommandations vaccinales générales (tableau II.17.1).
Tableau II.17.1 Vaccination contre les infections à pneumocoque (IP) (d’après le calendrier des vaccinations et recommandations vaccinales) (S = semaine).
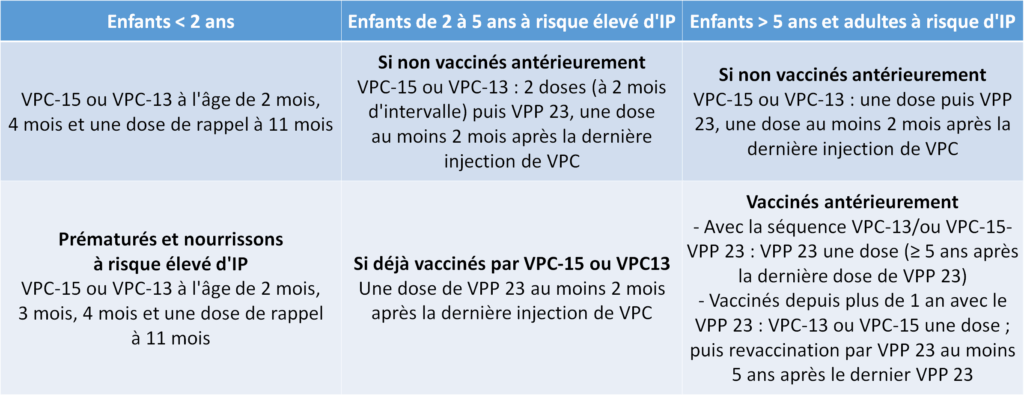
La vaccination par un vaccin pneumococcique conjugué 15-valent ou 13-valent est obligatoire pour tous les enfants nés après le 1er janvier 2018 selon le schéma de deux injections à 2 mois d’écart (à l’âge de 2 mois et à 4 mois) suivies d’un rappel à l’âge de 11 mois. Pour les patients à risque élevé d’infection à pneumocoque, plusieurs schémas vaccinaux existent associant les vaccins entre eux. Compte tenu de l’arrivée récente de nouveaux vaccins, ces schémas vont évoluer dans les années à venir (voir calendriers vaccinaux annuels).
| Points clés La vaccination est un élément essentiel à la prévention des infections à pneumocoque. Deux vaccins sont commercialisés, l’un conjugué, obligatoire en France pour tous les enfants et utilisable à partir de l’âge de 2 mois. L’autre vaccin, polysaccharidique non conjugué, est efficace à partir de l’âge de 2 ans. |
