Les papillomavirus sont des virus ubiquitaires infectant des animaux dont l’Homme. Ils ont un tropisme épithélial et sont responsables de lésions cutanéo-muqueuses majoritairement bénignes mais certains peuvent induire des cancers (virus oncogène), en particulier le cancer du col utérin.
CARACTÉRISTIQUES VIROLOGIQUES
TAXONOMIE
Famille des Papillomaviridae, avec de nombreux genres de papillomavirus. On dénombre près de 220 papillomavirus strictement humains (HPV, pour Human Papillomavirus). Les virions nus sont formés d’une capside icosaédrique de petite taille (55 nm).
GÉNOME
Leur génome est un ADN (acide désoxyribonucléique) bicaténaire circulaire d’environ 8 000 paires de bases. Il code dans sa région de transcription précoce (early) les protéines de réplication et dans sa région tardive (late) les protéines de structures, le tout sous le contrôle d’une origine de réplication.
PROTÉINES VIRALES
PROTÉINES DE CAPSIDES
Les protéines L1 et L2 forment les constituants de la capside. Les protéines L1 sont à la base des vaccins recombinants protéiques.
PROTÉINES NON STRUCTURALES (E1 À E7)
Elles sont impliquées dans la réplication, la transcription et également dans l’oncogenèse. Les protéines E6 et E7 sont oncogènes et responsables de la transformation cellulaire (perte de la régulation du cycle cellulaire) et de l’immortalisation cellulaire (multiplication infinie).
TROPISME ET RÉPLICATION
Les papillomavirus ont un tropisme pour les épithéliums malpighiens, cutanés pour certains, ou muqueux pour d’autres. Les HPV infectent initialement les cellules germinales de la couche basale des épithéliums avec une expression des gènes précoces sans réplication virale. Ces cellules sont particulièrement accessibles au niveau des jonctions entre épithéliums (jonction endo-exocol notamment). La réplication des HPV nécessite la multiplication et la différenciation des cellules épithéliales induites par les protéines E6/E7, puis une expression des protéines de capside L et une production virale dans les couches superficielles des épithéliums.
Le génome viral peut persister sous forme d’épisome (génome viral circulaire intranucléaire) dans les cellules basales sans conséquence autre qu’une latence virale avec de rares réactivations (immunodépression).
| Points clés Les papillomavirus sont de petits virus ubiquitaires à tropisme cutanéo-muqueux. Ils sont résistants dans l’environnement. Ils présentent une capacité de transformation de la cellule hôte notamment par leurs protéines oncogènes E6 et E7. |
DONNÉES ÉPIDÉMIOLOGIQUES
HPV À TROPISME CUTANÉ
L’infection cutanée par ces HPV est ubiquitaire et le plus souvent asymptomatique. L’acquisition se fait par contact cutané direct ou indirect (objet, eaux de baignade…) car les HPV sont des virus très résistants dans l’environnement.
On considère que ces virus constituent ce que l’on décrit désormais comme le virome cutané humain.
Ils peuvent, en fonction du terrain (prédisposition génétique, patient immunodéprimé…), être responsables de formes cliniques de sévérité très variable (verrues, épidermodysplasie verruciforme, maladie de Bowen, carcinome épidermoïde).
HPV À TROPISME MUQUEUX
Les HPV muqueux appartiennent pour la plupart aux alpha-HPV. L’infection génitale HPV est l’infection sexuellement transmissible (IST) la plus fréquente. Environ 80 % des individus seront infectés au niveau génital par HPV. Les prévalences les plus élevées sont retrouvées chez les personnes jeunes sexuellement actives (rôle important du nombre de partenaires). Les infections multiples à HPV sont observées. Les muqueuses oropharyngées et anales peuvent également être infectées.
Le risque de carcinogenèse est variable selon les génotypes d’HPV. On distingue ainsi des HPV à haut risque (HPV-HR) au nombre de 14 actuellement, tels les HPV16, 18 (+ 31, 33, 45…) et les HPV à bas risque (HPV-BR) tels les HPV6, 11, 70.
| Points clés Les infections HPV sont très fréquentes et le plus souvent asymptomatiques. Les HPV à tropisme muqueux sont la première cause d’IST. L’absence de clairance virale de certains HPV muqueux peut entraîner l’apparition de lésions précancéreuses génitales à risque d’évolution en cancer. Certains HPV muqueux sont à haut risque oncogène. Les HPV16 et 18 représentent plus de 70 % des étiologies cancéreuses associées aux papillomavirus (cancers génitaux et ORL [oto-rhino-laryngologie]). |
PHYSIOPATHOLOGIE ET MANIFESTATIONS CLINIQUES
Ces infections sont le plus souvent asymptomatiques avec une réplication virale spontanément contrôlée dans les mois qui suivent l’infection (clairance virale).
HPV CUTANÉS
Verrues : il s’agit de lésions bénignes (verrue plantaire, verrue vulgaire, verrue plane), le plus souvent spontanément résolutives. Épidermodysplasie verruciforme : maladie rare, survenant sur terrain génétique particulier et se manifestant par des lésions cutanées diffuses pouvant se transformer en cancer. Nombreux types d’HPV impliqués.
Maladie de Bowen, carcinome épidermoïde : certains types d’HPV pourraient être des cofacteurs, en plus de l’exposition solaire, dans le développement de ces cancers cutanés.
HPV MUQUEUX
Condylomes ano-génitaux : il s’agit de lésions planes ou acuminées, témoignant d’une prolifération bénigne des cellules épithéliales (« crêtes de coq » induites par HPV). Les HPV incriminés sont souvent HPV6 et 11 (HPV-BR).
Papillomatoses laryngées : tumeurs bénignes de la sphère ORL, souvent acquises par transmission de la mère à l’enfant lors de l’accouchement. HPV6 et 11 sont également les plus représentés dans ces pathologies.
HPV ET CANCERS
CANCERS HPV INDUITS
Cancer du col de l’utérus : un HPV-HR est associé dans 100 % des cas. Les HPV16 et 18 représentent près de 3/4 des cas. C’est la 2e cause de cancer chez la femme au niveau mondial. En France, 3 000 cas/an pour 1 100 décès (12ème cause de mortalité par cancer).
Cancer du canal anal : HPV est fréquemment associé aux cancers de la marge anale (90 %), avec une incidence plus importante chez les patients homosexuels et/ou infectés par le HIV.
Cancer du vagin, de la vulve ou du pénis : l’association avec HPV est moins systématique (25 à 70 %).
Cancers de l’oropharynx : les HPV-HR (HPV16 et 18) sont une cause croissante de cancers oropharyngés liés aux rapports sexuels orogénitaux (amygdale, langue). Dans les pays développés, ils supplantent en fréquence ceux induits par le tabac et l’alcool. Ils sont difficiles à dépister, conduisent à des traitements délabrants. Ils sont cependant de meilleur pronostic que les cancers ORL non HPV-induits.
MÉCANISMES DE LA CARCINOGENÈSE
Dans une proportion d’environ 10 à 15 % des cas, cette infection devient persistante (> 2 ans). L’infection persistante par un HPV-HR augmente la probabilité d’apparition de dysplasies de grades croissants (CIN 1 à 3, pour Cervical Intraepithelial Neoplasia). L’oncogenèse nécessite 10 à 15 ans d’évolution (figure III.4.1).
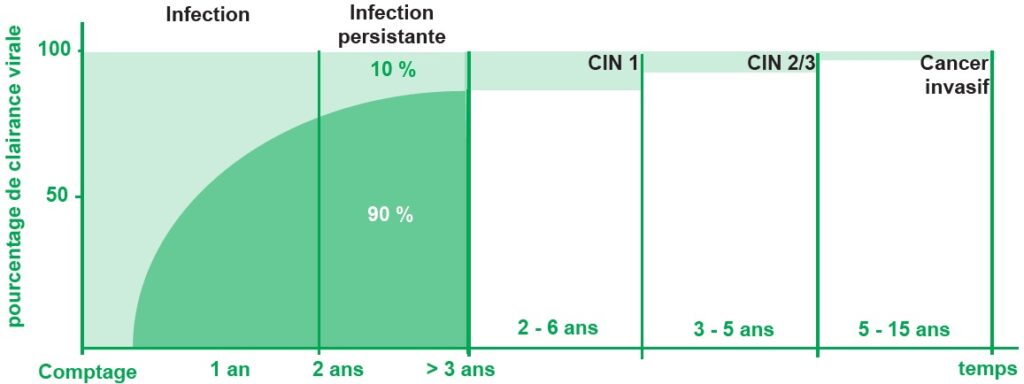
L’oncogenèse est liée à la surexpression des protéines E6 et E7. Ces protéines provoquent alors l’immortalisation des cellules infectées et leur transformation. Cette surexpression est souvent liée à un évènement génétique type intégration du génome viral (d’autres sont possibles) conduisant à une dérégulation de l’expression de E6 et E7 par défaut d’expression de protéines virales, E2 en particulier. Le gène codant E2 peut ainsi être inactivé par coupure lors de l’intégration du génome viral.
FACTEURS DE RISQUE
Le cancer du col utérin est favorisé par :
▪ infection persistante par un HPV-HR (HPV16 +++), nécessaire mais pas suffisant ;
▪ acquisition précoce, multiplicité des partenaires ;
▪ immunodépression ;
▪ accouchements multiples (allongement de la jonction endo-exocol, ectropion) ;
▪ facteurs génétiques prédisposants.
▪ environnement, comportement (tabagisme…).
| Points clés L’infection persistante par un HPV-HR est nécessaire à la carcinogenèse qui peut s’installer après plusieurs années en induisant des dysplasies du tissu épithélial. Ces dysplasies de grades croissants précèdent le développement d’un cancer, dont le plus fréquent est le cancer du col utérin. |
DIAGNOSTIC
DIAGNOSTIC DIRECT
▶ Le diagnostic virologique (test HPV-HR) n’a que peu d’intérêt pour les lésions bénignes cutanées et muqueuses. Il trouve par contre sa place dans la stratégie de dépistage organisé du cancer du col utérin et dans l’exploration des lésions non caractéristiques. Le test HPV est également utilisé, du fait de sa valeur prédictive négative de 100 %, pour s’assurer d’une clairance virale après traitement de lésions HPV-induites. Il repose sur la détection du génome (ADN ou ARNm E6E7) des HPV-HR par biologie moléculaire dans les prélèvements cellulaires de la jonction endo-exocol. Il peut éventuellement être complété par un génotypage viral par hybridation ou séquençage. D’autres marqueurs virologiques (charge virale, niveau d’expression de certains gènes…) ou cellulaires (niveau de méthylation de certains gènes…) sont actuellement à l’étude pour mieux évaluer le risque de carcinogenèse.
▶ Le frottis cervico-utérin (FCU) a maintenant des indications limitées. Le diagnostic des cancers est systématiquement histologique (anatomopathologie sur biopsie).
DIAGNOSTIC INDIRECT
Pas de diagnostic sérologique disponible.
| Points clés Le test HPV-HR participe en première ligne à la stratégie de dépistage organisé du cancer du col utérin. |
TRAITEMENT
Il n’y a pas de traitement antiviral spécifique.
Les lésions cutanéo-muqueuses bénignes (verrues, condylomes) peuvent être traitées par cryothérapie ou laser. L’imiquimod (agoniste du TLR8 conduisant à la production locale d’interféron antiviral) est indiqué en applications sur certaines lésions.
Le traitement des lésions du col dépendra du grade, de l’âge de la patiente et d’un éventuel désir de grossesse. Les lésions de bas grades sont surveillées. Les lésions plus importantes sont traitées par conisation (ablation partielle d’une région du col), ou un traitement conservatif par laser et cryothérapie afin de ne pas hypothéquer une grossesse future.
Les lésions cancéreuses relèvent d’une combinatoire thérapeutique (chirurgie, radiothérapie, chimiothérapie, immunothérapie) en fonction du type de cancer et de son stade.
Des essais sont actuellement en cours sur l’utilisation de vaccins thérapeutiques ciblant les protéines E6 et E7.
PRÉVENTION
La prévention des infections à HPV et celle des cancers HPV induits s’articulent autour d’une prévention primaire basée sur la vaccination et d’une prévention secondaire qui repose sur un dépistage organisé.
PRÉVENTION PRIMAIRE ET VACCINATION
La prévention est basée comme pour les autres IST sur la limitation du nombre de partenaires sexuels. À noter que l’usage du préservatif ne protège que partiellement contre l’infection par HPV.
La vaccination anti-HPV est recommandée pour les filles depuis 2007, et pour les jeunes garçons depuis 2021. Pratiquée avant la période d’activité sexuelle, cette vaccination est très efficace pour prévenir l’infection par les génotypes couverts par le vaccin et donc les cancers HPV-induits.
Cette vaccination est initiée entre 11 et 14 ans et le schéma est de deux doses vaccinales en 6 mois. Un rattrapage est également possible entre 15 et 19 ans inclus avec un schéma alors de 3 doses en 6 mois. L’âge minimum peut être descendu à 9 ans chez les enfants en attente d’une transplantation ou, au contraire, poussé à 26 ans pour les hommes ayant des relations sexuelles avec d’autres hommes. La vaccination ne couvrant pas tous les génotypes, elle ne dispense donc pas du dépistage organisé du cancer du col.
Les vaccins contiennent des pseudo-particules virales (VLP ou Virus Like Particles) constituées de protéines recombinantes L1 des principaux génotypes à HR (± BR). Deux vaccins sont actuellement disponibles, le Gardasil 9® (HPV6, 11, 16, 18, 31, 33, 45, 52 et 58) et le Cervarix® (HPV16 et 18). Le Gardasil 9® est recommandé pour débuter tout nouveau schéma vaccinal.
PRÉVENTION SECONDAIRE OU DÉPISTAGE ORGANISÉ
CHEZ LES JEUNES FEMMES À PARTIR DE 25 ANS
▶ Le dépistage systématique repose sur la cytologie. Le frottis cervico-utérin (FCU) permet de détecter les cellules infectées activement par HPV (koïlocytes) et les cellules dysplasiques.
▶ Les recommandations sont la réalisation tous les 3 ans d’un FCU après deux FCU normaux à 1 an d’intervalle.
▶ Tout résultat relevant d’atypies cellulaires type ASC-US (Atypical Squamous Cells of Undetermined Significance) devra conduire à la réalisation d’une colposcopie et d’un test HPV-HR. La colposcopie permet alors de repérer les éventuelles lésions et de diriger des biopsies dont l’analyse histologique permettra le diagnostic (grade de la dysplasie : CIN1-3 à cancer invasif).
CHEZ LES JEUNES FEMMES À PARTIR DE 30 ANS
Dans cette tranche d’âge, la faible prévalence des infections HPV augmente la valeur prédictive positive du test HPV-HR. Le test HPV est réalisé 3 ans après la dernière cytologie négative, et s’il est négatif, est renouvelé tous les 5 ans. Un test HPV positif doit déclencher une cytologie réflexe (FCU). Des autoprélèvements vaginaux sont proposés aux femmes n’ayant pas de suivi gynécologique.
| Points clés La vaccination et le dépistage organisé sont les 2 piliers de la prévention des cancers HPV induits. |
