Neisseira meningitidis, le méningocoque, est un pathogène majeur responsable d’infections invasives graves (méningites, bactériémies) et transmissibles.
CARACTÉRISTIQUES BACTÉRIOLOGIQUES
TAXONOMIE
Embranchement des Proteobacteria, famille des Neisseriaceae, genre Neisseria.
MORPHOLOGIE, CARACTÈRES CULTURAUX ET D’IDENTIFICATION
Cocci à Gram négatif, immobiles, non sporulés, disposés en diplocoques donnant un aspect en « grains de café » (figure II.11.1).
Le méningocoque n’est pas une bactérie aussi exigeante sur le plan de la culture que le gonocoque ou que Haemophilus influenzae. Néanmoins, cette espèce se développe mieux sur des milieux de culture enrichis : gélose au sang ou gélose au sang cuit (+++), incubés à 37 °C sous 5 % de CO2.
– Il s’agit d’une bactérie aérobie stricte.
– Sa croissance est rapide, en 24 à 48 h.
– Oxydase + et catalase +.
Il existe 12 sérogroupes fondés sur la composition de la capsule polyosidique.

FACTEURS DE VIRULENCE
Plusieurs facteurs de virulence interviennent dans les infections invasives à méningocoques (IIM), les plus importants étant : la capsule qui s’oppose à la phagocytose, les systèmes de captation du fer, les pili de type IV qui permettent d’adhérer aux cellules endothéliales et le lipo-oligosaccharide (endotoxine).
DONNÉES ÉPIDÉMIOLOGIQUES
En France, l’incidence des méningites à méningocoque est faible (de l’ordre de 0,7 à 0,8 cas pour 100 000 habitants, soit environ 500 cas par an) jusqu’en 2019. Cette incidence a diminué durant la période COVID pour atteindre 0,5 cas pour 100 000 habitants en 2022. Cette incidence remonte actuellement avec une létalité des IIM de 10 % (20 % en cas de purpura fulminans).
L’infection affecte surtout les sujets jeunes (deux pics : petite enfance et 15–24 ans), de façon sporadique, avec une saisonnalité montrant un pic annuel entre novembre et mars.
Des cas groupés ou des poussées épidémiques peuvent survenir avec des souches hypervirulentes.
Les quatre sérogroupes majoritaires en France sont actuellement le B (environ 40–50 %), le sérogroupe W (15–20 %), le C et le Y (10–15 % chacun).
Les méningites à N. meningitidis représentent environ 25 % des méningites bactériennes communautaires de l’adulte en France.
On retrouve une incidence élevée des IIM en Afrique sahélienne et subsaharienne, formant une « ceinture méningitique », avec des poussées épidémiques liées au sérogroupe A pendant la saison sèche.
PHYSIOPATHOLOGIE ET MANIFESTATIONS CLINIQUES
HABITAT
La bactérie est très fragile et ne survit pas dans le milieu extérieur. Le réservoir est strictement humain.
N. meningitidis colonise le rhinopharynx de l’Homme (portage asymptomatique temporaire chez 5 à 10 % de la population générale). C’est donc une bactérie commensale occasionnelle et non un pathogène strict.
La transmission est interhumaine directe par voie aérienne, à partir des sécrétions rhinopharyngées (toux, parole…), à la faveur d’un contact étroit (< 1 mètre) et prolongé (au moins 1 heure).
PHYSIOPATHOLOGIE
Colonisation du rhinopharynx (adhésion via pili) conduisant à un portage asymptomatique. Ce portage est rarement suivi d’une IIM.
Passage de N. meningitidis dans le sang à partir d’un réservoir rhinopharyngé sous l’influence de facteurs environnementaux (infection respiratoire virale récente par exemple) ou de facteurs liés à l’hôte.
Persistance de N. meningitidis dans la circulation sanguine grâce à la capsule qui permet à la bactérie de résister à la bactéricidie sérique et d’empêcher la phagocytose.
Passage éventuel de la barrière hémato-encéphalique grâce aux pili de type IV.
PRINCIPALES MANIFESTATIONS CLINIQUES
INFECTIONS INVASIVES À MÉNINGOCOQUE : RARES MAIS PARTICULIÈREMENT GRAVES
La durée d’incubation est de 2 à 10 jours.
▶ Bactériémie (méningococcémie) : +/– associée à un purpura pouvant être fulminans (purpura dont les éléments s’étendent rapidement en taille et en nombre, avec au moins un élément nécrotique ou ecchymotique de plus de 3 millimètres de diamètre associé à un syndrome infectieux sévère, non attribué à une autre étiologie) et à un choc septique rapide et sévère, mortel dans 20 % des cas.
▶ Méningite cérébrospinale (purulente) : début brutal avec syndrome méningé franc (céphalées, vomissements en jet, raideur de la nuque, photophobie).
▪ Létalité d’environ 10 % (jusqu’à 20 % en cas de purpura fulminans).
▪ Séquelles (15 %) : nécrose cutanée ± amputation, troubles neurologiques.
▪ Urgence diagnostique et thérapeutique.
▶ Autres localisations (plus rares) : arthrite, péricardite…
Les infections invasives à méningocoque sont des maladies à déclaration obligatoire.
FORMES NON INVASIVES (LOCALISÉES) : TRÈS RARES
▶ rhinopharyngite ;
▶ pneumonie…
FACTEURS DE RISQUE
Déficits immunitaires congénitaux, déficits en fragments terminaux du complément, asplénie…
DIAGNOSTIC
Le diagnostic étiologique des IIM comporte l’isolement et l’identification de la bactérie, la détermination du sérogroupe et le typage des souches, cette dernière analyse étant réalisée exclusivement par le centre national de référence. Une IIM est confirmée par la présence de méningocoques dans un site anatomique normalement stérile (établie par isolement des bactéries en culture ou mise en évidence de leur présence par des méthodes moléculaires ou immunologiques).
PRÉLÈVEMENTS
En fonction de la présentation clinique : LCR, hémoculture, biopsie cutanée (lésions purpuriques), liquide articulaire/ pleural/péricardique…
Les prélèvements sont à acheminer rapidement au laboratoire (urgence et bactérie fragile).
EXAMEN DIRECT
Après coloration de Gram, particulièrement contributif sur LCR, mais peu sensible (positif dans seulement 50 à 60 % des cas). La localisation des bactéries peut être intraleucocytaire (figure II.11.1). La présence de cocci à Gram négatif doit être transmise en urgence au clinicien.
CULTURE
L’ensemencement doit être rapide (germe très sensible à la chaleur et au froid).
Les colonies sont observées après 24 à 48 h d’incubation à 37 °C en aérobiose ou sous 5 % de CO2 sur gélose au sang ou sur gélose au sang cuit (+++).
Les colonies sont oxydase +.
L’identification est effectuée par spectrométrie de masse MALDI-TOF (Matrix Assisted Laser Desorption Ionisation/Time of Flight) ou à défaut selon les caractères biochimiques (glucose +, maltose +, γGT +).
DIAGNOSTIC PAR AMPLIFICATION GÉNIQUE
Détection par amplification génique (PCR ou LAMP [Loop-Mediated Isothermal Amplification]) d’ADN de méningocoque directement à partir du prélèvement (LCR, sang total ou sérum, biopsie de lésions purpuriques). Sur la base des techniques d’amplification génique, des trousses dites « panels syndromiques » ont été développées afin d’identifier les agents infectieux responsables de méningite et d’encéphalite.
Intérêt en cas de culture négative (notamment si antibiothérapie préalable au prélèvement), mais ne se substitue pas à la culture qui est indispensable pour obtenir l’antibiogramme.
GROUPAGE
Indispensable afin d’instaurer la prophylaxie vaccinale des sujets contacts.
SÉROGROUPAGE
À partir de colonies sur gélose : agglutination des antigènes bactériens avec des anticorps anticapsulaires.
GÉNOGROUPAGE
Détection par PCR du sérogroupe capsulaire en ciblant les gènes codant les génogroupes de méningocoque les plus fréquents (B, C, Y, W pour la France), soit directement à partir des échantillons biologiques ou à partir des colonies.
CARACTÉRISATION DES SOUCHES : PHÉNOTYPAGE ET GÉNOTYPAGE PAR LE CNR
Toute souche ou matériel positif pour le méningocoque doit être envoyé au CNR (centre national de référence) pour typage complet : phénotypage (détermination des sérogroupes capsulaires ainsi que des sérotypes et sérosous-types) et génotypage (Multi Locus Sequence Typing [MLST]) et séquençage de nouvelle génération (NGS).
SENSIBILITÉ AUX ANTIBIOTIQUES ET ANTIBIOGRAMME
Bactérie généralement sensible à la plupart des antibiotiques, même si la fréquence des souches de sensibilité diminuée à la pénicilline G augmente.
SENSIBILITÉ AUX ANTIBIOTIQUES
En France, plus de 40 % des souches présentaient une sensibilité diminuée à la pénicilline et à l’amoxicilline.
ANTIBIOGRAMME
▶ Détermination de CMI (concentration minimale inhibitrice) par bandelettes E-test® sur gélose MH-F (Mueller-Hinton au sang supplémenté en NAD pour bactéries exigeantes [F pour « Fastidious »]).
▶ Tester au minimum une pénicilline (G ou A), une céphalosporine de 3e génération (C3G) injectable (ceftriaxone ou céfotaxime), la rifampicine, et la ciprofloxacine.
▶ Détection de la résistance à haut niveau aux pénicillines par production de bêta-lactamase (exceptionnelle) par technique chromogénique (test à la nitrocéphine®).
TRAITEMENT
Le traitement des différentes formes d’IIM doit être débuté le plus tôt possible et dès la suspicion d’IIM. Il repose sur un seul schéma thérapeutique : C3G initialement à dose méningée, puis adaptation à réception de l’antibiogramme. D’après l’actualisation 2017 de la conférence de consensus de la SPILF (Société de pathologie infectieuse de langue française) (2008) pour les méningites :
▶ traitement de 1ère intention d’une méningite bactérienne avec examen direct du LCR positif à cocci à Gram négatif :
▪ ceftriaxone (IV) ou céfotaxime (IV) ;
▪ en cas d’allergie aux bêta-lactamines : ciprofloxacine ou rifampicine ;
▶ traitement d’une méningite bactérienne après documentation du méningocoque :
▪ si souche sensible : amoxicilline ou maintien de la C3G (IV) ;
▪ si souche résistante : céfotaxime ou ceftriaxone (IV).
Durée de traitement antibiotique : 4 à 7 jours (selon l’évolution).
Dans tous les cas, les antibiotiques sont administrés à fortes doses.
Dexaméthasone : à débuter le plutôt possible et au plus tard dans les 12 h après la première dose d’antibiotique, et seulement pendant 4 jours.
PRÉVENTION
Les cas d’IIM doivent être déclarés à l’ARS (agence régionale de santé) locale (maladie à déclaration obligatoire).
PRÉVENTION PRIMAIRE
RECOMMANDATIONS GÉNÉRALES
Vaccin monovalent conjugué C (tableau II.11.1).
Vaccination obligatoire des nourrissons à 5 mois puis rappel à 12 mois.
Vaccin monovalent B (tableau II.11.1). Vaccination obligatoire des nourrissons à partir de 3 mois (calendrier vaccinal 2024).
Tableau II.11.1 Vaccins antiméningococciques et principales recommandations (calendrier vaccinal 2024).
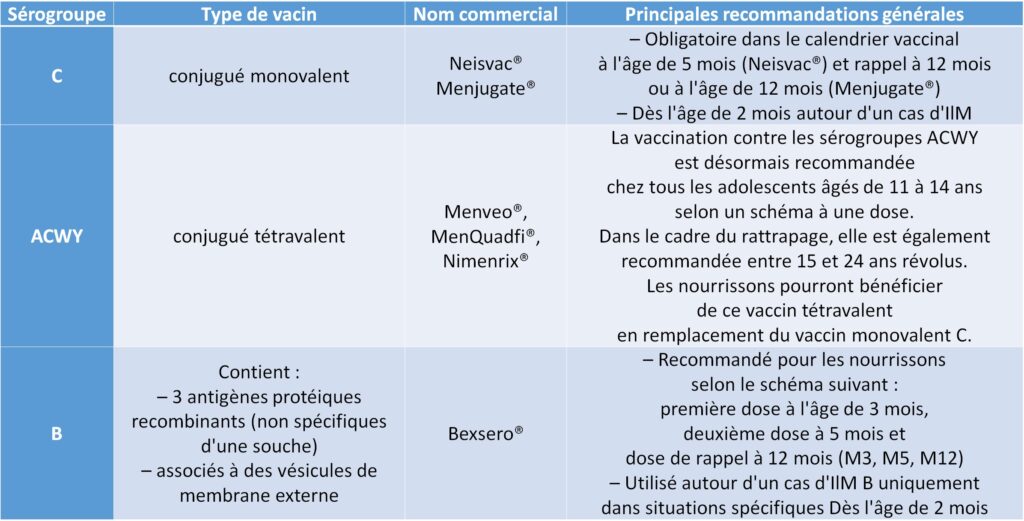
RECOMMANDATIONS PARTICULIÈRES
Vaccin tétravalent conjugué ACWY et/ou vaccin contre le sérogroupe B dans les indications suivantes :
▶ susceptibilité particulière (déficit en fraction terminale du complément, asplénie…) ;
▶ personnel de laboratoire de recherche travaillant sur le méningocoque ;
▶ séjour en Afrique sahélienne/sub-saharienne et pèlerinage à La Mecque (vaccin ACWY).
MESURES DE CONFINEMENT
Pour les patients hospitalisés, toute suspicion d’IIM doit faire l’objet de précautions complémentaires de type « gouttelettes ». Ces mesures peuvent être levées après 24 heures de traitement par C3G correspondant à l’éradication du portage pharyngé.
PRÉVENTION SECONDAIRE
Objectif : éradication du portage de la souche virulente chez les sujets contacts pour prévenir les cas secondaires.
Elle repose sur l’antibioprophylaxie et la vaccination + précautions complémentaires de type gouttelettes (masque si distance < 1 mètre avec le cas), levées 24 heures après le début d’une antibiothérapie active sur le portage rhinopharyngé.
Antibioprophylaxie des sujets contacts : permet une protection immédiate et à court terme.
À administrer dans les plus brefs délais (dans les 24 à 48 heures après le diagnostic, au plus tard dans les 10 j) :
▶ rifampicine par voie orale, pendant 2 jours ;
▶ en cas de contre-indication ou de résistance documentée à la rifampicine (exceptionnelle) :
▪ ceftriaxone par voie injectable en dose unique ; ou
▪ ciprofloxacine par voie orale en dose unique. Vaccination de l’entourage : permet une protection à plus long terme mais retardée.
Cette vaccination pour les sujets contacts de l’entourage du malade est à effectuer le plus rapidement possible, et dans un délai de 10 jours après le dernier contact avec le cas index et selon le sérogroupe du cas index (tableau II.11.1).
