Listeria est un genre bactérien qui compte 26 espèces à ce jour, dont Listeria monocytogenes. Listeria monocytogenes est la seule espèce pathogène pour l’Homme provoquant la listériose, l’une des zoonoses les plus graves.
CARACTÉRISTIQUES BACTÉRIOLOGIQUES
TAXONOMIE
Listeria monocytogenes. Famille des Listeriaceae. Genre Listeria.
MORPHOLOGIE, CARACTÈRES CULTURAUX ET D’IDENTIFICATION
Ce sont de petits bacilles à Gram positif, régulièrement colorés, non sporulés, isolés ou disposés en palissades. Ces bacilles sont immobiles à 37 °C mais mobiles à 20 °C suite à l’expression des flagelles à cette température.
Cette bactérie n’est pas exigeante et se multiplie facilement sur les milieux de culture ordinaires avec une température d’incubation optimale de 37 °C.
Cette bactérie possède une grande capacité de survie et de croissance y compris dans les conditions extrêmes : sécheresse/ humidité, pH ; températures (0-45 °C) avec une multiplication possible aux basses températures (bactérie psychrotrophe) ; de congélations-décongélations successives ; de hautes concentrations en sels (jusqu’à 10–20 %, saumures) (bactéries halophiles).
Type respiratoire : aérobie-anaérobie facultatif, bêtahémolyse sur gélose au sang, catalase positive, hydrolyse rapide de l’esculine en 2 à 3 h à 35 ± 2 °C.
FACTEURS DE VIRULENCE
Le pouvoir pathogène de cette bactérie tient dans sa capacité à envahir et se multiplier dans les cellules eucaryotes (cellules épithéliales et phagocytaires). Les principaux facteurs de virulence impliqués dans ce parasitisme intracellulaire facultatif sont des adhésines, dont les internalines (responsables de l’adhésion et de la pénétration dans les cellules) et la listériolysine O (LLO, hémolysine responsable de la bêtahémolyse sur gélose au sang et de la lyse de la vacuole de phagocytose dans la cellule-hôte, permettant la multiplication intracellulaire dans le cytosol).
| Points clés ● Listeria monocytogenes est la seule espèce pathogène pour l’Homme parmi toutes les espèces décrites du genre Listeria. ● C’est un bacille à Gram positif non sporulé. ● Cette bactérie intracellulaire facultative est capable d’envahir les cellules eucaryotes. |
DONNÉES ÉPIDÉMIOLOGIQUES
La listériose est une zoonose qui évolue sous forme de cas sporadiques, auxquels peuvent s’ajouter des cas groupés voire des épidémies. La principale voie de contamination est alimentaire.
La listériose est une maladie rare en France et touche environ 300 à 400 personnes par an, associée à un fort taux de mortalité (20 à 30 %) et de séquelles, taux largement supérieur aux autres pathogènes transmis par voie alimentaire. Dans les pays industrialisés, la listériose touche principalement des groupes de populations à risque comme les femmes enceintes, les nouveau-nés (3e étiologie d’infection néonatale bactérienne), les personnes âgées et/ou les patients immunodéprimés ou fragilisés par des pathologies chroniques.
PHYSIOPATHOLOGIE ET MANIFESTATIONS CLINIQUES
HABITAT ET NICHES ÉCOLOGIQUES
Cette bactérie possède une grande capacité de survie et de croissance, y compris dans les conditions extrêmes.
Elle ne résiste pas à la pasteurisation. La cuisson des aliments à risque constitue le mode de prévention le plus efficace.
Ainsi, Listeria monocytogenes est une bactérie ubiquitaire largement répandue :
▶ dans l’environnement : sol, eaux, égouts, débris végétaux dont les ensilages sont des réservoirs naturels ;
▶ dans le monde animal : mammifères domestiqués (responsable de mammites chez les ovins, bovins, caprins) et autres (oiseaux, poissons, produits de la mer).
Ainsi, la bactérie contamine fréquemment les matières premières à l’origine de certains de nos aliments, notamment les produits carnés et laitiers, les légumes. Du fait de la capacité de la bactérie à se multiplier à basse température, elle peut être retrouvée dans les aliments réfrigérés à durée de conservation longue dans les réfrigérateurs ménagers (charcuteries, produits laitiers en particulier les fromages au lait cru, les produits de la mer [fruits de mer, poissons fumés…] et les végétaux) et s’y multiplier lors de leur stockage.
PHYSIOPATHOLOGIE
Chez l’Homme, le mode de contamination le plus fréquent est l’ingestion d’aliments contaminés au cours des différents maillons de la production agroalimentaire.
La transmission in utero de la mère à son foetus est transplacentaire, faisant suite à une bactériémie maternelle. Après ingestion, la bactérie peut traverser la barrière intestinale et atteindre la circulation lymphatique et sanguine, puis le foie et la rate. Sans contrôle de l’infection, une bactériémie expose alors les organes cibles tels le système nerveux central et l’unité foeto-placentaire chez la femme enceinte (figure II.8.1).
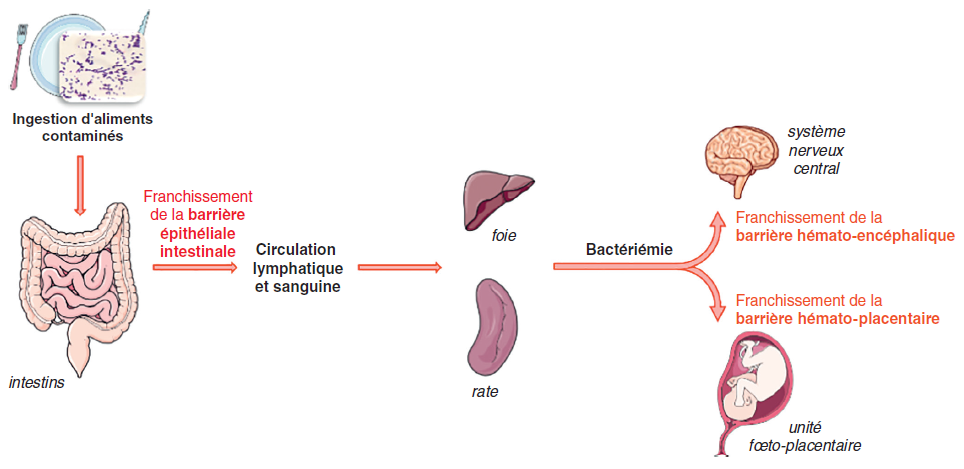
PRINCIPALES MANIFESTATIONS CLINIQUES
Suite à l’ingestion d’aliments contaminés, les premiers signes cliniques apparaissent après une période d’incubation allant de quelques jours dans les formes septicémiques ou neurologiques, à plusieurs semaines dans les formes maternelles. La listériose est associée à des tableaux sévères, à l’origine d’une létalité importante (20 % ; 50–60 cas par an).
Formes materno-foetales et néonatales (nouveau-nés < 28 jours et femmes enceintes) :
Pendant la grossesse, l’infection est en général sans conséquence pour la femme et passe le plus souvent inaperçue. Les signes cliniques éventuels se réduisent à un pic fébrile ou un épisode pseudo-grippal non spécifique et de résolution spontanée.
Mais l’infection a des conséquences pernicieuses et dramatiques chez le foetus ou le nouveau-né avec, selon le terme de la grossesse, des fausses couches, des morts foetales in utero, des accouchements prématurés et des infections néonatales parmi lesquelles on distingue :
▶ des formes précoces sévères d’infection d’emblée généralisée, pouvant associer sepsis et atteintes multiviscérales avec foyers granulomateux multiples (granulomatosis infantiseptica), et dont l’évolution est d’autant plus dramatique que l’infection survient tôt dans la grossesse ;
▶ des formes tardives : contamination de l’enfant en fin de grossesse ou en per-partum ; le nouveau-né naît sain mais une atteinte neuroméningée se déclare quelques jours plus tard. Le pronostic est, dans ce cas, plus favorable.
Autres formes (dites de « l’adulte » hors contexte materno- néonatal). Chez l’adulte, l’infection par Listeria monocytogenes se traduit par :
▶ une bactériémie isolée, le plus souvent associée à un sepsis (2/3 des cas) ;
▶ une infection du système nerveux central (méningite ou méningo-encéphalite ou rhombencéphalite) ;
▶ d’autres formes focales (infections cutanéo-muqueuses, ostéo-articulaires, endovasculaires, pleuro-pulmonaires, oculaires ou péritonites par exemple) faisant suite à une dissémination bactériémique, mais elles restent rares (< 10 % des cas).
FACTEURS DE RISQUE
La listériose touche surtout des populations à risque :
▶ les personnes âgées (≥60 ans) ;
▶ les femmes enceintes et leurs nouveau-nés ;
▶ les personnes dont les défenses immunitaires sont perturbées, à la suite d’un traitement (corticothérapie, chimiothérapie, immunosuppresseur) ou d’une maladie sous-jacente (hémopathie, pathologie chronique, éthylisme, cancer, diabète, cirrhose, etc.).
| Points clés ● La listériose est une maladie rare mais grave due à Listeria monocytogenes transmise à l’Homme par voie alimentaire. ● Sa transmission se fait par voie transplacentaire de la mère à son foetus in utero. ● Elle est responsable de formes materno-néonatales, de bactériémie et de sepsis ou d’infections du système nerveux central. ● Les populations à risque sont les femmes enceintes et les nouveau-nés, les personnes âgées, et les personnes dont le système immunitaire est fragilisé. |
DIAGNOSTIC
Si la listériose peut être suspectée face à des signes cliniques évocateurs, le diagnostic de certitude est à ce jour microbiologique. Chez une femme enceinte, toute fièvre inexpliquée au cours de la grossesse doit faire suspecter une listériose et conduire à la prescription d’hémocultures dans le but d’identifier précocement les formes maternelles isolées.
DIAGNOSTIC DIRECT
PRÉLÈVEMENTS
Quelle que soit la présentation clinique, les hémocultures doivent être systématiquement réalisées, car elles permettent de mettre en évidence la bactériémie fréquemment observée. C’est d’ailleurs le seul moyen de diagnostiquer une listériose maternelle isolée survenant au cours de la grossesse.
L’indication pour la réalisation d’autres prélèvements varie selon la présentation clinique : liquide céphalo-rachidien (LCR), liquide gastrique, liquide amniotique, placenta…
Particularités chez la femme enceinte : compte tenu du mode de contamination par voie transplacentaire, le prélèvement le plus contributif est idéalement une biopsie placentaire. Cette zone permet l’observation d’abcès placentaires listériens macroscopiquement visibles. Le liquide amniotique, les lochies peuvent également permettre d’isoler L. monocytogenes dans les formes évoluées touchant le foetus. Les urines ainsi que le prélèvement vaginal ne sont pas adaptés pour le diagnostic d’une listériose materno-foetale.
Chez le nouveau-né infecté, le liquide gastrique, le méconium et les prélèvements périphériques permettent d’isoler L. monocytogenes. Dans un contexte d’infection néonatale, les prélèvements d’une hémoculture et de LCR doivent les accompagner. Les produits d’autopsie contribuent au diagnostic dans les cas de mort foetale in utero.
Pour les autres infections, les prélèvements sont variables en fonction des sites de l’infection.
La recherche spécifique de L. monocytogenes dans les selles n’est pas recommandée à ce jour.
EXAMEN DIRECT
L’examen microscopique après coloration de Gram permet de visualiser de petits bacilles à Gram positif isolés ou disposés en palissades (figure II.8.2A). Dans les formes neuroméningées, le LCR présentera un aspect macroscopique clair ou opalescent, une pléiocytose modérée avec une formule panachée ou une prédominance de polynucléaires neutrophiles à la cytologie après une coloration au MGG (May-Grünwald Giemsa).
CULTURE ET IDENTIFICATION
Caractères culturaux et principaux éléments d’orientation diagnostique
Cette bactérie n’est pas exigeante et se multiplie facilement sur les milieux de culture ordinaires avec une température d’incubation optimale de 37 °C. Sa croissance est cependant favorisée sur milieux enrichis en sang (5 %). Type respiratoire : aérobie-anaérobie facultatif. Colonies translucides entourées d’une zone de bêtahémolyse sur gélose au sang (figure II.8.2B). Hydrolyse rapide de l’esculine en 2 à 3 h à 35 ± 2 °C.
Une identification rapide au genre Listeria est possible avec l’utilisation du MALDI-TOF (Matrix Assisted Laser Desorption Ionisation/Time of Flight) couplé à la spectrométrie de masse ou à défaut par des galeries d’identification manuelles de type API® ou par systèmes automatisés.
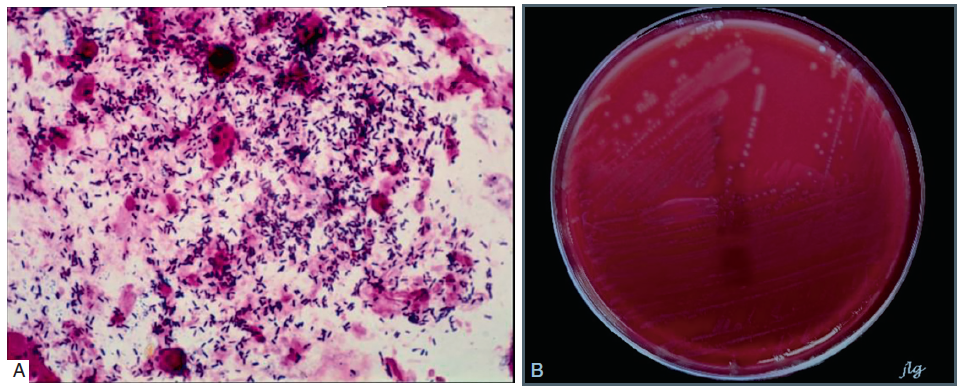
AUTRES MÉTHODES DE DÉTECTION
Diagnostic moléculaire par PCR spécifique ou par PCR multiplex syndromiques : les panels méningite/encéphalite incluent le plus souvent Listeria monocytogenes dans leurs cibles.
DIAGNOSTIC INDIRECT
Le sérodiagnostic de la listériose n’est pas recommandé et il n’y a pas de test actuellement commercialisé.
| Points clés ● L’identification repose sur la morphologie des colonies et l’observation d’une zone de bêtahémolyse sur gélose au sang. ● Le diagnostic est fait principalement à partir du LCR et des hémocultures ainsi que des prélèvements périnataux dans le contexte d’une grossesse et d’une suspicion d’infection materno-foetale. ● L’amplification génique améliore la sensibilité du diagnostic de listériose, notamment en cas d’antibiothérapie préalable. |
SENSIBILITÉ AUX ANTIBIOTIQUES ET ANTIBIOGRAMME
L. monocytogenes est naturellement sensible à de nombreux antibiotiques, actif contre les bactéries Gram positif à l’exception notable des céphalosporines, y compris les céphalosporines de 3e génération (C3G), de la fosfomycine et des fluoroquinolones.
L’antibiogramme doit au minimum comporter les antibiotiques suivants : pénicilline G, ampicilline ou amoxicilline, gentamicine, érythromycine, et triméthoprime-sulfaméthoxazole selon les recommandations du CA-SFM/EUCAST (Comité de l’antibiogramme de la Société française de microbiologie/ European Committee on Antimicrobial Susceptibility Testing).
Les résistances acquises sont très rares et aucune résistance n’a été décrite pour des antibiotiques d’intérêt clinique dont l’amoxicilline et la gentamicine.
| Points clés ● L. monocytogenes présente une résistance naturelle aux céphalosporines de 3e génération. ● En revanche, pas de résistance acquise pour des antibiotiques d’intérêt clinique. |
TRAITEMENT
TRAITEMENT DE RÉFÉRENCE
À ce jour, l’amoxicilline associée ou non avec la gentamicine est le traitement de référence.
L’association d’un aminoside permet d’obtenir un effet bactéricide dans les formes sévères et bactériémiques chez les sujets immunodéprimés.
▶ Pour les formes neuro-méningées de l’adulte : amoxicilline à fortes doses (ou doses dites « méningées ») pendant 21 jours + gentamicine pendant 5 jours
▶ Pour les formes bactériémiques sans atteinte neuroméningée et sans immunodépression : amoxicilline pendant 15 jours ± gentamicine en cas de forme sévère.
PRINCIPALE ALTERNATIVE EN CAS D’ALLERGIE AUX BÊTA-LACTAMINES
Le cotrimoxazole est régulièrement utilisé en monothérapie mais la rifampicine et la vancomycine peuvent être également envisagées.
PRÉVENTION
La prévention de la listériose chez les personnes à risque consiste à éviter de consommer des aliments le plus fréquemment contaminés, à respecter certaines règles d’hygiène lors de la manipulation des aliments et bien cuire les aliments (femmes enceintes +++).
Pas de vaccination, ni d’indication à une antibioprophylaxie pour les personnes à risque.
Déclaration obligatoire (DO) de tous les cas de listériose et de l’envoi centralisé des souches au centre national de référence des Listeria pour leur caractérisation et leur typage.
Cette surveillance, associée à un renforcement de la réglementation en vigueur pour les industriels de l’agro-alimentaire (contrôles sanitaires, normes (absence de L. monocytogenes dans 25 g d’aliment si l’aliment permet le développement des Listeria, taux < 100/g si l’aliment ne permet pas sa multiplication) et sanctions), a permis de réduire significativement l’incidence de la listériose depuis leur mise en place dans le début des années 1990.
| Points clés ● L’amoxicilline associée ou non avec la gentamicine constitue le traitement de référence de la listériose. ● La prophylaxie passe par la sensibilisation des personnes à risque sur les aliments à éviter. ● La listériose est une maladie à déclaration obligatoire (MDO). |
