DÉFINITIONS ET CIRCONSTANCES DIAGNOSTIQUES
BACTÉRIÉMIE
Une bactériémie correspond à la présence de bactéries viables dans le sang, en situation physiologique (bactériémie asymptomatique lors de la digestion ou du brossage des dents par exemple) ou pathologique (bactériémie symptomatique).
N.B. : Le terme de septicémie ne doit plus être employé car il associe deux notions différentes, la notion de bactériémie (définition bactériologique) et la notion de gravité de l’infection (sepsis, définition clinique).
SEPSIS
Le sepsis correspond à une dysfonction d’organe menaçant le pronostic vital et causé par une réponse inappropriée de l’hôte à une infection. Tout sepsis n’est pas nécessairement associé à une bactériémie.
Le sepsis correspond à une infection suspectée associée à au moins 2 signes de dysfonctions d’organe qui sont appréciés par la pression partielle d’oxygène dans le sang (PaO2 – mesure des gaz du sang) ; des plaquettes, de la bilirubine, de la créatininémie, de la tension artérielle et du score de Glasgow (mesure de la confusion).
Des critères simplifiés appelés quick SOFA (qSOFA), utilisables hors réanimation, sont proposés en dépistage de patients pouvant avoir un sepsis :
▶ pression artérielle systolique inférieure ou égale à 100 mm Hg ;
▶ fréquence respiratoire supérieure à 22/min ;
▶ confusion (score de Glasgow inférieur à 15).
La présence de 2 critères qSOFA identifie des patients risquant d’avoir un mauvais pronostic et justifiant d’un monitorage accru, et/ou d’un traitement spécifique et/ou de prendre un avis en réanimation.
Le choc septique est défini par l’association de 3 critères :
1-sepsis ;
2-besoin de drogues vasopressives (catécholamines) ;
3-lactates > 2 mmol/L ; l’acide lactique est le marqueur d’une hypoperfusion périphérique.
Remarque : les termes sepsis grave ou sévère ne doivent plus être employés.
ENDOCARDITE INFECTIEUSE (EI)
L’EI est une infection secondaire à la greffe et à la multiplication d’un agent infectieux sur l’endocarde valvulaire (EI sur valve native, lésée ou apparemment saine) ou sur du matériel prothétique intracardiaque (EI sur prothèse valvulaire) au décours d’une bactériémie. Cette infection est à l’origine de la formation d’une végétation infectée associant fibrine, leucocytes, plaquettes et l’agent pathogène en cause.
C’est une pathologie peu fréquente (environ 2 200 cas par an en France) qui touche principalement le sujet d’âge supérieur à 60 ans. Les EI sont localisées au coeur gauche dans 90 % des cas. La létalité globale est d’environ 20 %, plus précisément de 10 % à 50 % selon le pathogène et le terrain (présence/ absence de prothèse).
SIGNES CLINIQUES
Les signes cliniques révélateurs les plus fréquents sont :
▶ des signes infectieux : fièvre prolongée, altération de l’état général, splénomégalie ;
N.B. : toute fièvre inexpliquée chez un patient à risque doit entraîner la recherche d’une EI.
▶ des signes cardiaques : apparition ou modification d’un souffle cardiaque, poussée d’insuffisance cardiaque ;
▶ des manifestations extracardiaques immunologiques ou vasculaires au premier plan desquelles des signes cutanés comme le faux panaris d’Osler, le purpura pétéchial, l’érythème plantaire de Janeway… Il existe d’autres signes : signes respiratoires, ophtalmologiques, rhumatologiques, neurologiques et rénaux.
Au total, l’EI est considérée comme une maladie systémique de présentation polymorphe.
SITUATIONS À RISQUE
Toxicomanie intraveineuse, matériel implanté (prothèse valvulaire en particulier), antécédents de cardiopathie, infection ou procédure invasive (soins dentaires, chirurgie, piercing…) au niveau d’une porte d’entrée potentielle de micro-organismes.
ÉCHOGRAPHIE CARDIAQUE
L’échographie cardiaque transthoracique (ETT) ou transoesophagienne (ETO) permet de visualiser des végétations.
APPARITION DE COMPLICATIONS DE L’ei
▶ Complications cardiaques : insuffisance cardiaque, atteinte plurivalvulaire, abcès, désinsertion de prothèse valvulaire, etc.
▶ Complications à distance : emboles septiques avec développement de foyers infectieux secondaires qui peuvent parfois être responsables des manifestations inaugurales : spondylodiscite, anévrisme mycotique (infection de la paroi vasculaire entraînant un risque de rupture) ; essaimage d’antigènes bactériens et de complexes immuns qui peuvent parfois être responsables de lésions de vascularite, d’accident vasculaire cérébral ou autres.
| Points clés ● La bactériémie a une définition microbiologique, le sepsis a une définition clinique. ● L’EI est une maladie peu fréquente mais grave. ● L’EI est secondaire à une bactériémie et touche l’endocarde valvulaire ou du matériel prothétique intracardiaque. ● L’EI est considérée comme une maladie systémique et a une présentation polymorphe. |
DIAGNOSTIC BIOLOGIQUE ET AGENTS ÉTIOLOGIQUES
PRÉLÈVEMENT D’HÉMOCULTURES
Une hémoculture correspond à la mise en culture du sang dans 2 flacons d’hémoculture : un flacon dit aérobie et un flacon dit anaérobie (soit une paire de flacons). Sachant que le volume de sang total analysé est le paramètre capital permettant de documenter microbiologiquement une bactériémie, il est recommandé d’analyser 40 à 60 mL de sang chez l’adulte soit 4 à 6 flacons prélevés (figure I.2.1).

Un prélèvement pour hémoculture est classiquement constitué d’un flacon aérobie (flacon à bouchon bleu dans cet exemple) et d’un flacon anaérobie (flacon à bouchon bordeaux dans cet exemple) ; il convient de prélever 4 à 6 flacons afin d’analyser le volume total de sang recommandé (40–60 mL).
N.B. : différents types de flacons sont disponibles (flacons dits pédiatriques destinés aux prélèvements de volumes sanguins plus faibles, flacons avec résines permettant l’adsorption d’antibiotiques…). Il existe des flacons spécifiques pour la culture des levures ; toutefois, les flacons aérobies standards permettent également la culture des levures et le diagnostic de fongémie.
CAS GÉNÉRAL
Les hémocultures sont théoriquement prélevées au moment d’un pic fébrile ou au moment de frissons. Cependant, l’augmentation de la sensibilité des systèmes d’hémoculture (milieu de culture, système de détection) rend cette précaution moins indispensable aujourd’hui.
De préférence, les hémocultures doivent être prélevées avant antibiothérapie ou à distance d’un traitement antibiotique. Une antisepsie cutanée rigoureuse doit être respectée avant le prélèvement de manière à limiter les risques de contamination des flacons d’hémoculture par des bactéries commensales de la peau.
Auparavant, il était recommandé de réaliser trois paires de flacons pour hémoculture à 1 heure d’intervalle (prélèvements multiples). Dans les autres situations, il a été montré que prélever deux ou trois paires de flacons pour hémocultures en une seule fois (prélèvement unique) permettait de diminuer les risques de contamination tout en conservant une sensibilité de détection équivalente équivalente et cette pratique est actuellement utilisée.
La recommandation des prélèvements à 1 heure d’intervalle est toujours valable pour le diagnostic d’EI.
Le sang est directement introduit dans les flacons d’hémoculture lors du prélèvement (environ 10 mL par flacon). Lors de ce prélèvement, les facteurs bactéricides contenus dans le sang sont ainsi dilués dans le bouillon de culture contenu dans le flacon.
Les flacons d’hémocultures doivent être transportés au laboratoire rapidement. Ils sont alors placés dans un automate d’hémocultures et incubés à 37 °C avec agitation des flacons. L’enregistrement de l’évolution du dégagement de CO2 dans les flacons par des mesures répétées permet une détection automatisée des flacons positifs dans lesquels une croissance microbienne a eu lieu (augmentation du dégagement de CO2). Le délai de positivité est indiqué. Les flacons pour lesquels aucune croissance n’a été détectée au bout de 5 jours sont considérés comme négatifs.
Le délai de positivité dépend de plusieurs paramètres, en particulier de la nature de l’agent infectieux et de la quantité de bactéries dans le sang.
La durée d’incubation dans l’automate peut être prolongée en cas de suspicion d’EI (14 à 21 j).
CAS DES HÉMOCULTURES DIFFÉRENTIELLES (DIAGNOSTIC DES BACTÉRIÉMIES LIÉES AUX CATHÉTERS)
L’objectif est de déterminer si un cathéter ou une chambre implantable est la porte d’entrée d’une bactériémie.
Le principe est de prélever simultanément des paires de flacons pour hémoculture en périphérie (ponction veineuse directe, en général au pli du coude) et par le matériel potentiellement en cause (cathéter, chambre implantable…).
Suivant le principe que le délai de positivité dépend de la quantité de bactéries présentes initialement, le matériel sera considéré comme étant la porte d’entrée de l’infection si les flacons prélevés via ce cathéter sont déclarés positifs plus précocement que ceux prélevés en périphérie (délai différentiel de positivité considéré comme significatif : 2 heures).
PRISE EN CHARGE D’UNE HÉMOCULTURE DÉTECTÉE POSITIVE PAR L’AUTOMATE
La chronologie des étapes de prise en charge d’un flacon d’hémoculture positif est présentée en figure I.2.2.
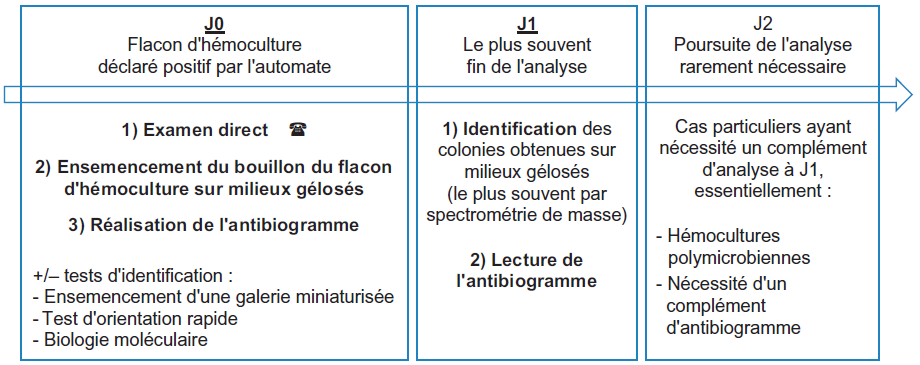
1-À J0 : examen microscopique après coloration de Gram et ensemencement de milieux gélosés incluant des milieux permettant la culture des bactéries exigeantes (gélose chocolat PolyViteX incubée en atmosphère enrichie en CO2 et gélose au sang incubée en anaérobiose). Une étude de la mobilité bactérienne peut éventuellement être réalisée par examen microscopique entre lame et lamelle (état frais). Les résultats de l’examen microscopique après coloration de Gram doivent être communiqués au médecin dans l’heure.
Le bouillon de culture détecté positif peut également être utilisé pour réaliser un antibiogramme qui sera lu à J1.
Des protocoles peuvent également permettre d’identifier la bactérie présente par spectrométrie de masse MALDI-TOF (Matrix Assisted Laser Desorption Ionisation/Time of Flight) directement à partir du bouillon d’hémoculture.
Des solutions ont été récemment développées pour permettre d’identifier rapidement par biologie moléculaire les principaux micro-organismes responsables de bactériémies et fongémies, et de détecter certains gènes de résistance aux antibiotiques (diagnostic syndromique). Les résultats sont disponibles en environ 1 heure.
2-À J1 : identification des colonies par étude des protéines bactériennes par spectrométrie de masse ou, à défaut, par étude du métabolisme bactérien (galeries miniaturisées d’identification) et lecture de l’antibiogramme.
3-L’analyse peut éventuellement se poursuivre à J2 dans certains cas (hémocultures polymicrobiennes ayant nécessité un réisolement des différentes colonies obtenues en culture à J1, complément d’antibiogramme nécessaire…).
INTERPRÉTATION D’HÉMOCULTURES POSITIVES
La différenciation d’une hémoculture contaminée et d’une hémoculture reflétant une vraie bactériémie est réalisée en fonction de l’espèce bactérienne, du nombre de flacons positifs, et éventuellement du délai de positivité.
Par exemple, un staphylocoque à coagulase négative* (SCN) qui est un contaminant potentiel (commensal de la peau), sera considéré comme potentiellement responsable de la bactériémie si au moins 2 flacons d’hémoculture sur 4 à 6 prélevés (prélèvement unique) ou si au moins 2 paires de flacons pour hémoculture (prélèvements multiples) sont positives avec la même espèce de SCN présentant le même profil de résistance aux antibiotiques. À l’inverse, pour les bactéries ne faisant pas partie du microbiote cutané (Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus…), un seul flacon positif (prélèvement unique ou multiple) suffit à incriminer la bactérie identifiée dans la bactériémie.
RECHERCHE DE LA PORTE D’ENTRÉE ET PRINCIPALES ÉTIOLOGIES BACTÉRIENNES
Les portes d’entrée des bactéries impliquées dans les bactériémies sont variables (tableau I.2.1), la bactériémie pouvant survenir à la faveur d’infections, d’effractions traumatiques ou chirurgicales, ou en présence de dispositifs invasifs (cathéter, sonde urinaire, sonde d’intubation…) au niveau de ces portes d’entrée.
Escherichia coli et les staphylocoques sont les bactéries principalement identifiées lors de bactériémies communautaires (30 % chacun) devant les autres bacilles à Gram négatif (20 %) et le pneumocoque (10 % des cas). Les bactéries principalement impliquées sont répertoriées selon la porte d’entrée dans le tableau I.2.1.
Tableau I.2.1 Principales bactéries impliquées dans les bactériémies selon la porte d’entrée.

BILAN BIOLOGIQUE ASSOCIÉ
Numération formule sanguine (NFS), C-Reactive Protein (CRP) ou procalcitonine (PCT), bilan d’hémostase, bilan biochimique sanguin standard (ionogramme, glycémie, créatinine, enzymes hépatiques), éventuellement gaz du sang et dosage des lactates sanguins.
PARTICULARITÉS DES ENDOCARDITES INFECTIEUSES
Dans l’absolu, toutes les bactéries peuvent être responsables d’EI. Les portes d’entrée sont principalement bucco-dentaires, digestives et cutanées (dont cathéter).
EI À HÉMOCULTURES POSITIVES (90–95 % des cas)
Les EI sont majoritairement dues aux streptocoques, entérocoques* et staphylocoques. De plus, 95 % des EI sur valves natives et 90 % des EI sur prothèse valvulaire sont associées à des hémocultures positives.
▶ EI sur valve native : les streptocoques (40 %) et entérocoques (10 %) sont responsables d’environ 50 % des cas, les staphylocoques sont responsables de 40 % des cas dont 30 % attribuables à S. aureus.
▶ EI sur valve prothétique : les streptocoques (20 %) et entérocoques (15 %) sont responsables de 35 % des cas, les staphylocoques sont également responsables de 35 % des cas dont 20 % attribuables à S. aureus.
Certaines EI sont dues à des agents infectieux de croissance difficile tels que les bactéries du groupe HACCEK* (voir ci-après), Brucella spp.*, les streptocoques déficients (Abiotrophia spp.*, Granulicatella spp.*, Gemella spp.*) et les levures. La prolongation de l’incubation des flacons et l’ensemencement de flacons spécifiquement dédiés à la culture des levures peuvent permettre d’obtenir une culture positive.
EI À HÉMOCULTURES NÉGATIVES (5–10 % DES CAS)
Ces EI impliquent des bactéries ne se cultivant pas sur milieu synthétique, principalement des bactéries à croissance intracellulaire : Coxiella burnetii*, Bartonella spp.*, Tropheryma whipplei*, Chlamydia spp*., Mycoplasma spp.*
DIAGNOSTIC MICROBIOLOGIQUE
▶ Hémocultures (trois paires de flacons pour hémoculture soit 6 flacons) ;
▶ Culture du matériel ou de la valve explantée en cas de prise en charge chirurgicale.
DIAGNOSTIC MOLÉCULAIRE
▶ PCR universelle (ADN ribosomique 16S) sur sang prélevé avec anticoagulant (EDTA) ou sur valve explantée : intérêt tout particulier pour la mise en évidence des bactéries pouvant être associées à des EI à hémocultures négatives ;
▶ sérologies : Brucella spp.*, Coxiella spp.*, Bartonella spp.*
PLACE DES RÉSULTATS MICROBIOLOGIQUES DANS LES CRITÈRES DIAGNOSTIQUES DE LA DUKE UNIVERSITY
La positivité des hémocultures montrant une bactérie susceptible de causer des EI est l’un des 2 critères majeurs du diagnostic d’EI (tableau I.2.2).
Le diagnostic d’EI est considéré comme certain si présence de :
▶ 2 critères majeurs ;
▶ 1 critère majeur et 3 critères mineurs ;
▶ 5 critères mineurs.
La recherche de bactéries par PCR (sur sang ou valve explantée) et la réalisation de sérodiagnostics complémentaires peuvent être contributives au diagnostic, notamment en cas d’EI possible mais non certaine d’après les critères de la Duke University.
Tableau I.2.2 Critères diagnostiques de l’EI selon la Duke University.

| Points clés ● Prélèvement des hémocultures avec une asepsie rigoureuse ; ● Importance majeure du volume total de sang analysé (40–60 mL) pour poser le diagnostic de bactériémie ; ● Détection automatique des flacons positifs avec indication du délai de positivité ; ● Réalisation d’hémocultures différentielles pour déterminer si un cathéter ou un matériel implantable est le point de départ d’une bactériémie ; ● Prise en charge des flacons d’hémoculture positifs au laboratoire similaire à la prise en charge classique d’un échantillon biologique en bactériologie (identification + antibiogramme) avec une interprétation dépendant de l’identification de la bactérie en cause et du nombre de flacons positifs ; ● Portes d’entrée et étiologies bactériennes variées ; ● Streptocoques et staphylocoques sont les bactéries les plus souvent impliquées dans les EI ; ● Existence d’EI à hémocultures négatives nécessitant un diagnostic moléculaire (PCR) ou sérologique ; ● Importance des résultats microbiologiques (critère majeur de la Duke University) pour le diagnostic d’EI. |
TRAITEMENT
TRAITEMENT DES BACTÉRIÉMIES/SEPSIS EN DEHORS DES EI
ANTIBIOTHÉRAPIE PROBABILISTE INTRAVEINEUSE
Elle doit être initiée très rapidement, sans attendre les résultats des hémocultures, en fonction de la porte d’entrée et des bactéries suspectées.
Une monothérapie est possible mais une bithérapie sera instaurée chez les patients présentant des signes de gravité. Classiquement, il s’agit alors d’une association entre une bêta-lactamine (céphalosporine de 3e génération) et un aminoside (tableau I.2.3). En effet, les deux familles d’antibiotiques sont synergiques et la bactéricidie rapide de l’aminoside permet une élimination rapide des bactéries du sang, limitant les risques de choc septique.
L’aminoside est administré durant les 48 premières heures uniquement ; la durée totale du traitement varie de 5 à 14 jours selon la bactérie, la présentation clinique (signes de gravité) et le terrain (présence de matériel).
Avec l’augmentation des souches de bacilles à Gram négatif multirésistantes, d’autres molécules comme les carbapénèmes pourront être utilisées en fonction du contexte et de l’épidémiologie locale.
Tableau I.2.3 Antibiothérapie probabiliste en fonction de la bactérie suspectée.

ADAPTATION DU TRAITEMENT À RÉCEPTION DE L’ANTIBIOGRAMME
L’antibiothérapie probabiliste doit être réévaluée dès les résultats disponibles de l’antibiogramme afin d’adapter l’antibiothérapie en cas de bactérie résistante ou de réaliser une désescalade antibiotique (réduction du spectre de l’antibiothérapie).
COMPLÉMENTS DE LA PRISE EN CHARGE
▶ prise en charge des défaillances viscérales liées au sepsis ;
▶ prise en charge de la porte d’entrée :
▪ traitement de l’infection à l’origine de la bactériémie (cutanée, bucco-dentaire, urinaire, pulmonaire…) ;
▪ retirer le matériel à l’origine de l’infection le cas échéant (sonde urinaire, cathéter, sonde d’intubation trachéale…) ;
▶ prise en charge d’éventuels foyers secondaires d’infection.
TRAITEMENT DES EI
ANTIBIOTHÉRAPIE
Les végétations ne sont pas vascularisées et contiennent un inoculum bactérien important. Les traitements doivent donc être bactéricides, de longue durée (4 à 6 semaines le plus souvent) et de fortes posologies sont administrées par voie intraveineuse.
▶ antibiothérapie probabiliste (réalisée uniquement si sepsis ou choc septique, chirurgie valvulaire devant être réalisée en urgence) ;
En général, il s’agit d’une association entre une bêta-lactamine et un aminoside. Par exemple, association amoxicilline + cloxacilline + gentamicine pour une EI sur valve native chez un patient non allergique aux bêta-lactamines. Dans le cas général, les aminosides sont habituellement associés pendant les 2 premières semaines.
▶ adaptation de l’antibiothérapie aux résultats des hémocultures (cas le plus fréquent) :
N.B. : pour les bactéries à Gram positif, l’alternative aux bêta-lactamines en cas de résistance ou d’allergie est la vancomycine ou un autre glycopeptide.
CHIRURGIE
La chirurgie (réparation ou remplacement valvulaire, retrait de prothèse infectée) est indiquée en cas de défaillance cardiaque, d’infection non contrôlée, de végétations ou de lésions de grandes tailles. Elle est pratiquée dans 40 à 50 % des cas.
AUTRES
La porte d’entrée doit être traitée si une infection y persiste. Une recherche de complications et/ou de localisations secondaires doit être réalisée par imagerie (scanner).
N.B. : les traitements anticoagulants (héparine, antivitamines K) et antiagrégants plaquettaires sont contre-indiqués en raison du risque hémorragique.
| Points clés Bactériémies : ● Antibiothérapie intraveineuse ; ● Bithérapie fréquente, probabiliste avant documentation microbiologique ; ● Adaptation du traitement en fonction de l’antibiogramme. EI : ● Traitements intraveineux de longue durée ; ● Le plus souvent avec association d’antibiotiques ; ● Dépendant de la bactérie en cause et du type d’EI (sur valve native ou sur prothèse) ; ● Chirurgie associée dans certains cas. |
PRÉVENTION
▶ limiter le matériel étranger (indications et durée d’implantation) : cathéter, sonde urinaire…
▶ retirer le matériel lors d’une suspicion d’infection et le remplacer si besoin ;
▶ asepsie rigoureuse lors de la réfection des pansements ;
▶ prévention des infections associées au soin (site opératoire, dispositifs invasifs).
Cas particulier des EI :
▶ hygiène bucco-dentaire (maintien d’un bon état dentaire, consultations régulières chez le dentiste) ; hygiène cutanée (désinfection immédiate des plaies, éviter les gestes à risque avec effraction cutanée : piercings, tatouages, acupuncture…) ;
▶ exploration de toute fièvre d’origine inexpliquée ;
▶ suivi cardiologique régulier ;
▶ sevrage d’une toxicomanie intraveineuse.
Antibioprophylaxie :
Réservée uniquement aux patients à haut risque d’EI (antécédents d’EI, cardiopathies congénitales cyanogènes, porteurs de prothèse valvulaire), celle-ci sera réalisée avant toute procédure à haut risque, notamment les procédures dentaires (manipulation de la gencive ou de la région péri-apicale ou effraction muqueuse).
Elle sera réalisée par administration d’une dose unique d’amoxicilline ou de clindamycine en cas d’allergie aux pénicillines, 1 à 2 heures avant le geste.
