Campylobacter jejuni est la première cause bactérienne d’entérites (campylobactériose) dans les pays développés devant les salmonelloses, avec une prédominance en période estivale.
CARACTÉRISTIQUES BACTÉRIOLOGIQUES
TAXONOMIE
Famille des Campylobacteraceae, genre Campylobacter. À ce jour, le genre Campylobacter comprend plus de 30 espèces et 10 sous-espèces. Plusieurs d’entre elles ont été décrites comme pathogènes chez l’homme.
MORPHOLOGIE, CARACTÈRES CULTURAUX ET D’IDENTIFICATION
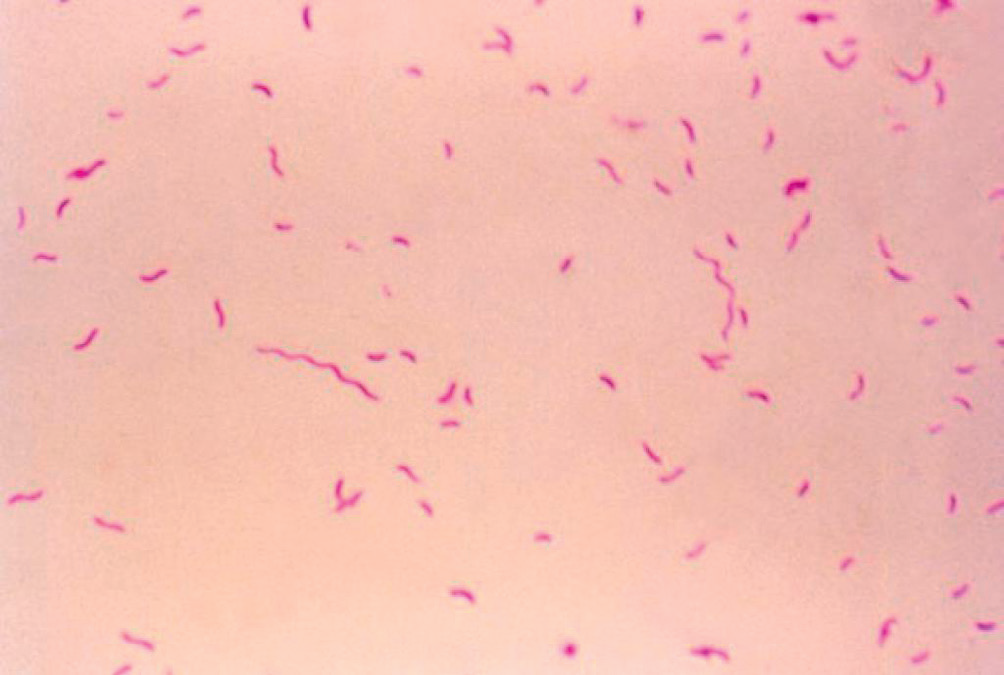
C. jejuni est un bacille à Gram négatif de forme spiralée ou incurvée (figure II.1.1). Les bactéries sont mobiles, possédant une ciliature polaire leur conférant une mobilité caractéristique dite en « vol de moucheron ».
C. jejuni est une bactérie de culture exigeante favorisée par une incubation en atmosphère micro-aérophile. Des milieux particuliers ont été développés pour la mettre en évidence à partir des selles.
C’est une espèce thermo-tolérante (optimum de croissance à 40–42 °C) se multipliant à 37 °C en 1 à 3 jours.
Les Campylobacter sont positifs pour les tests de l’oxydase et de la catalase.
FACTEURS DE VIRULENCE
C. jejuni adhère aux cellules épithéliales intestinales par de multiples adhésines présentes à sa surface : lipo-oligosaccharide (LOS), protéines de la membrane externe, polysaccharide capsulaire, pili, flagelline… La protéine de liaison à la fibronectine CadF induit un signal cellulaire conduisant à l’internalisation de la bactérie.
Parmi les toxines produites, la toxine CDT (Cytolethal Distending Toxin) est produite par toutes les souches, mais en quantité variable.
Le LOS de certains sérogroupes présente un mimétisme moléculaire avec les gangliosides des nerfs périphériques humains. Une réponse immunitaire inappropriée peut donner naissance à des auto-anticorps dirigés contre des antigènes du soi au niveau de la gaine de myéline des nerfs (voir Complications post-infectieuses, Item II.1).
| Points clés ● Campylobacter jejuni est un bacille mobile à Gram négatif de forme spiralée ou incurvée. ● Les principaux facteurs de virulence identifiés sont de nombreuses adhésines dont le lipo-oligosaccharides (LOS) qui possède une analogie structurale avec des constituants de la gaine de myéline, et la toxine CDT (Cytolethal Distending Toxin). |
DONNÉES ÉPIDÉMIOLOGIQUES
L’infection à Campylobacter est la première cause de diarrhées infectieuses d’origine bactérienne dans les pays développés. C. jejuni représente 85 % des isolements de Campylobacter en France. Les complications restent rares (décès < 0,1 %) et surviennent surtout chez les personnes fragiles. Une grande partie des patients restant asymptomatiques, l’incidence est probablement largement sous-estimée.
En France, les campylobactérioses correspondent à 30 % des infections d’origine alimentaire et 30 % des hospitalisations associées à ces infections. Elles prédominent en été, avec une incidence plus élevée chez l’enfant.
PHYSIOPATHOLOGIE ET MANIFESTATIONS CLINIQUES
HABITAT
L’infection à Campylobacter est une zoonose. C. jejuni colonise le tube digestif de nombreux animaux, en particulier celui des oiseaux sauvages et domestiques, considérés comme les hôtes naturels. La voie majoritaire de transmission à l’Homme est indirecte et se fait par l’ingestion d’aliments contaminés ou insuffisamment cuits. C. jejuni ne se multiplie pas dans les aliments et les campylobactérioses sont le plus souvent sporadiques. La consommation de volaille est souvent incriminée (30 % des cas). Des contaminations par du lait cru et des eaux de boisson ont été décrites. La transmission directe à partir d’animaux infectés est possible et concerne des populations exposées (éleveurs, vétérinaires, ouvriers d’abattoir, égoutiers…). Les jeunes animaux de compagnie sont aussi connus pour être des sources de transmission.
PHYSIOPATHOLOGIE
C. jejuni colonise principalement les couches muqueuses de l’épithélium du jéjunum car elle est bien adaptée à la vie dans le mucus.
Après adhésion aux cellules épithéliales, C. jejuni envahit le tissu sous la muqueuse intestinale en traversant les cellules épithéliales (voie transcellulaire) ou en migrant entre les cellules (voie paracellulaire). En réponse, les cellules produisent des cytokines comme l’interleukine 8 (IL-8) à l’origine du recrutement de cellules de l’immunité innée. Leur action entraîne une réponse pro-inflammatoire massive d’où une inflammation intestinale conduisant à des diarrhées et finalement à la clairance de la bactérie par l’hôte. La réponse immunitaire primaire est orientée vers une réponse cellulaire médiée par les lymphocytes Th1. C. jejuni peut persister dans les cellules infectées.
PRINCIPALES MANIFESTATIONS CLINIQUES
ENTÉRITES
L’incubation dure en moyenne de 2 à 5 jours. Les symptômes les plus courants sont la diarrhée (~ 85 %) parfois sanglante (~ 15 %), des douleurs abdominales, de la fièvre, des céphalées et des vomissements. La plupart des malades se rétablissent sans traitement en 3 à 4 jours.
COMPLICATIONS INFECTIEUSES SYSTÉMIQUES
Ces complications sont rares (< 1 %) et surviennent chez des personnes âgées et/ou immunodéprimées (bactériémies).
COMPLICATIONS POST-INFECTIEUSES
La principale complication est le syndrome de Guillain-Barré (1 cas pour 1 000 infections). C. jejuni serait la cause de 20 à 50 % des cas attribuables au syndrome de Guillain-Barré. C’est une polyradiculonévrite le plus souvent réversible qui survient en général trois semaines après l’entérite, pouvant laisser des séquelles et entraînant une mortalité dans 2 à 3 % des cas. Cette maladie auto-immune inflammatoire du système nerveux périphérique est due à l’analogie structurale entre la partie terminale du LOS de la bactérie et un constituant de la gaine de myéline.
Comme d’autres bactéries entéro-pathogènes, C. jejuni peut être à l’origine de syndromes post-infectieux de type arthrite réactionnelle, urticaire et érythème noueux.
FACTEURS DE RISQUE
Toutes les personnes sont vulnérables, mais certaines populations sont plus sensibles : enfants, personnes âgées et personnes immunodéprimées. Les voyages (pays à ressources limitées) constituent un facteur de risque d’infection.
| Points clés ● Les oiseaux constituent le principal réservoir de C. jejuni et la contamination se fait essentiellement par voie alimentaire, le plus souvent après consommation de volaille. ● La symptomatologie est essentiellement digestive et C. jejuni représente la principale cause de gastro-entérites bactériennes dans les pays développés, devant les salmonelloses. ● Le syndrome de Guillain Barré est la complication post-infectieuse la plus fréquente et la plus grave. |
DIAGNOSTIC
DIAGNOSTIC DIRECT
C. jejuni est isolé essentiellement des prélèvements de selles, plus rarement à partir d’hémocultures.
EXAMEN MICROSCOPIQUE
La coloration de Gram d’un échantillon de selles (coproculture) permet d’observer des bacilles spiralés à Gram négatif (figure II.1.1) ainsi que des polynucléaires neutrophiles, orientant le diagnostic.
CULTURE ET IDENTIFICATION
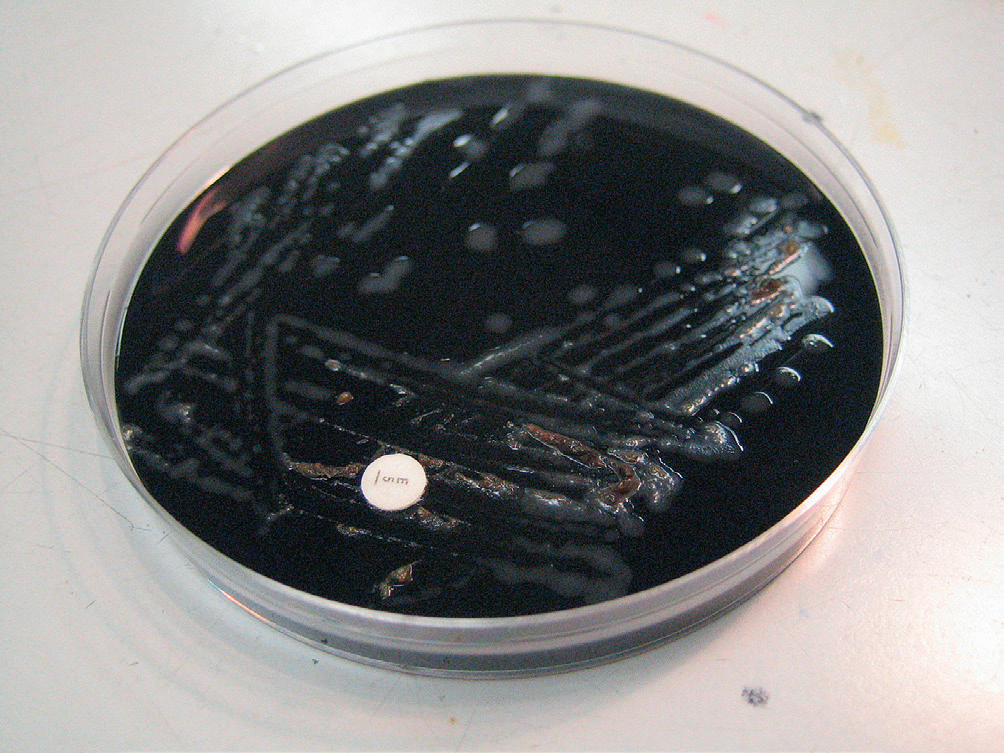
À partir des échantillons de selles, l’ensemencement se fait soit sur des milieux sélectifs et enrichis à base de sang supplémentés en facteurs de croissance et contenant des antibiotiques/antifongiques (exemple, milieu de Skirrow), soit sur des milieux au charbon (exemple, milieu de Karmali), qui absorbent les radicaux libres oxygénés toxiques. Les colonies sont observées habituellement après 48 h d’incubation à 37 °C ou à 42 °C en micro-aérophilie, avec formation de colonies qui s’étalent, lisses, mucoïdes et grisâtres (figure II.1.2). Des géloses chromogènes sont également disponibles.
Après croissance sur milieu solide, l’identification sera réalisée par spectrométrie de masse (MALDI-TOF [Matrix Assisted Laser Desorption Ionisation/Time of Flight]), éventuellement par PCR, ou utilisation de galeries d’identification miniaturisées.
AUTRE MÉTHODE DE DÉTECTION
Des kits de PCR multiplex permettent une « approche syndromique » par la détection de divers micro-organismes et virus entéro-pathogènes dans les selles.
DIAGNOSTIC INDIRECT
La sérologie ne se fait que dans des centres spécialisés. Son intérêt se limite aux cas de pathologies post-infectieuses.
| Points clés ● Le diagnostic à partir de selles ou d’autres types de prélèvements (hémoculture…) peut se faire par culture sur milieu sélectif ou non, incubés en atmosphère micro-aérophile. ● La détection directe par PCR dans les selles est très sensible et spécifique. |
SENSIBILITÉ AUX ANTIBIOTIQUES ET ANTIBIOGRAMME
Les Campylobacter présentent des résistances naturelles à de nombreuses familles de bêta-lactamines (carboxy-, uréido-pénicillines, monobactames et céphalosporines) dues à leur faible affinité pour les protéines liant les pénicillines (PLP) et à un défaut de pénétration de ces molécules. Ces bactéries sont aussi naturellement résistantes aux glycopeptides, aux streptogramines et au triméthoprime.
Les principales classes d’antibiotiques actives sur C. jejuni sont les macrolides, les pénicillines A comme l’amoxicilline (± acide clavulanique), les carbapénèmes, les fluoroquinolones, les tétracyclines et les aminosides. Cependant, les résistances acquises à certains de ces antibiotiques sont fréquentes :
▶ la résistance aux macrolides par mutations dans le gène de l’ARNr 23S, reste très rare (< 1 %) ;
▶ la résistance à l’ampicilline est élevée (~ 30 %) et est due à la production d’une bêta-lactamase (oxacillinase). C. jejuni reste sensible à l’association amoxicilline-acide clavulanique (l’acide clavulanique ayant une activité intrinsèque sur C. jejuni) et aux carbapénèmes ;
▶ la résistance aux fluoroquinolones est de plus en plus importante (60 % de résistance à la ciprofloxacine). Elle est due à des mutations au niveau de la QRDR (Quinolone resistance determining region) du gène gyrA (codant pour une des sous-unités de l’ADN gyrase) ;
▶ la résistance aux tétracyclines s’élève à 40 % (acquisition d’un plasmide portant le gène tetO) ;
▶ la résistance à la gentamicine est quasi nulle.
TRAITEMENT
ENTÉRITES
En premier lieu, il convient d’éviter la déshydratation, en particulier chez les sujets fragiles.
Le traitement antibiotique des infections intestinales est indiqué seulement pour des infections graves ou des sujets fragiles. Il diminue le portage. Le traitement de 1ère intention repose sur les macrolides ou apparentés. L’azithromycine est administrée par voie orale, en dose unique ou pendant 3 jours. Les alternatives sont l’amoxicilline-acide clavulanique ou une fluoroquinolone (ciprofloxacine ou lévofloxacine), après vérification de la sensibilité par antibiogramme.
BACTÉRIÉMIES
Le traitement des infections systémiques repose sur l’utilisation d’une association bactéricide d’antibiotiques comme la gentamicine et une bêta-lactamine (amoxicilline ± acide clavulanique ou imipénème).
PRÉVENTION
La prophylaxie repose sur des mesures d’hygiène.
MESURES D’HYGIÈNE COLLECTIVES
En industrie agroalimentaire (élevages, abattoirs, ateliers), des bonnes pratiques d’hygiène sont mises en place pour limiter les risques de contamination. Les eaux potables sont chlorées avant distribution.
MESURES D’HYGIÈNE INDIVIDUELLES
Le lavage des mains au moment de la préparation des repas et après contact avec des animaux, ainsi que le lavage des fruits et légumes, des ustensiles en contact avec les aliments crus, sont des mesures de prévention classiques en milieu domestique. Il faut réaliser une cuisson suffisante (au moins 60 °C) des aliments (viande), et éviter la consommation de lait non pasteurisé.
| Points clés ● La résistance aux macrolides est très rare à la différence des résistances à l’amoxicilline, aux fluoroquinolones et aux tétracyclines. ● L’azithromycine est l’antibiotique de choix dans le traitement d’une infection digestive ; une association bactéricide est nécessaire en cas d’infections systémiques. ● La prévention repose sur des mesures d’hygiène strictes. |
